Fotodegradacja wybranych ksenobiotyków organicznych
Wprowadzenie
Konwencja sztokholmska z 2001 r. dotycząca trwałych zanieczyszczeń organicznych (TZO) obejmuje 12 grup lub związków chemicznych [12]. Zaliczono do nich polichlorowane dibenzodioksyny (PCDD), polichlorowane dibenzofurany (PCDF), polichlorowane bifenyle (PCB) oraz dziewięć polichlorowanych węglowodorów (aldryna, dieldryna, endryna, DDT, mirex, toksafen, heksachlorobenzen (HCB), chlordan, heptachlor). W 2009 r. do tej grupy zanieczyszczeń włączono kolejne jedenaście związków, a obecnie proponuje się uzupełnienie listy o kolejne trzy [2, 6]. Dane literaturowe wskazują, że do trwałych zanieczyszczeń środowiska zalicza się także wielopierścieniowe węglowodory aromatyczne (WWA), chlorowcoorganiczne oznaczane jako adsorbowane na węglu aktywnym AOX, pochodne nonylofenolu i nonylofenololetoksylaty z 1-2 grupami etoksy-(NPE, NPEO), 2-etyloheksyloftalany (DEPH). Oprócz wymienionych coraz częściej zwraca się uwagę na obecność w środowisku tzw. „emerging contaminants”, do których zalicza się produkty powstające podczas uzdatniania (UPU) i dezynfekcji wody (UPD), związki o estrogenicznej aktywności biologicznej (EDC) oraz biologicznie aktywne farmaceutyki (PhAC), nanomateriały, składniki kosmetyków a także impregnaty zabezpieczające przed zapłonem (flame retardants) [9, 24]. Mimo tego, że mikrozanieczyszczenia organiczne zaliczane są do substancji opornych na rozkład, to w zmieniających się warunkach środowiska mogą ulegać wielokierunkowym przemianom, tj. z udziałem mikroorganizmów oraz fizycznym i chemicznym. Wśród przemian abiotycznych wymienia się utlenianie i reakcje z innymi składnikami środowiska (powstawanie produktów pochodnych), a także fotodegradację. W artykule przestawiono dane literaturowe dotyczące przebiegu rozkładu wybranych związków organicznych w procesach fotodegradacji oraz utleniania chemicznego wspomaganego ekspozycją na promieniowanie ultrafioletowe.
Podstawy teoretyczne procesu fotodegradacji
Proces fotodegradacji przebiega w naturalnych warunkach w środowisku lecz dotyczy jedynie powierzchniowej warstwy gleby i wód powierzchniowych. Intensywność promieniowania UV docierającego do Ziemi (długość fali λ powyżej 286,3 nm) zależy od pory roku, dnia, szerokości geograficznej, wysokości nad poziomem morza, zachmurzenia oraz wielkości dziury ozonowej. Fotodegradacja może być bezpośrednia lub pośrednia. Bezpośrednia to zwykle proces utlenienia następujący pod wpływem cząstki, która zaabsorbowała foton. Bezpośrednimi efektami działania promieniowania UV może być powstawanie nowych związków chemicznych, zrywanie wiązań chemicznych, a w rezultacie destrukcja substancji organicznych. Fotoliza pośrednia natomiast przebiega pod wpływem reakcji z rodnikami •OH, których liczba oraz reaktywność zależą od intensywności promieniowania ultrafioletowego. W środowisku wodnym oba procesy przebiegają jednocześnie. Czynnikami przyspieszającymi proces mogą być mikroorganizmy, algi czy substancje humusowe [29].
W warunkach technicznych usuwanie trwałych zanieczyszczeń organicznych z roztworów wodnych może być prowadzone w procesach zaawansowanego utleniania (AOP – Advanced Oxydation Processes). Są one realizowane jako procesy chemiczne oraz fotochemiczne. Procesy chemiczne skupiają się wokół utleniania z wykorzystaniem silnych utleniaczy, utleniania elektrochemicznego lub w warunkach nadkrytycznych, a także mokrego utleniania powietrzem. Fotochemiczne procesy natomiast, to fotoliza, fotodegradacja, fotokatalityczny rozkład i sonifikacja. Do utleniania stosowane są silne utleniacze takie jak ozon, ditlenek diwodoru oraz odczynnik Fentona czy nadmanganian. Skuteczność usuwania zanieczyszczeń z roztworów wodnych z wykorzystaniem AOP zależy głównie od rodzaju i stężenia związków organicznych ulegających utlenianiu, obecności innych związków organicznych (tert-butanol, izopropanol) i mineralnych (Fe2+, Cu+, chlorki, węglany, wodorowęglany), które stymulują lub hamują powstawanie rodników OH•, odczynu środowiska, rodzaju i dawki utleniacza, czasu reakcji, a także długości fali i intensywności promieniowania UV. Ponadto ważne jest, w którym miejscu ciągu technologicznego uzdatniania wody lub oczyszczania ścieków zastosowano utlenianie. Zaawansowane metody utleniania pozwalają na rozkład toksycznych i trudnobiodegradowalnych zanieczyszczeń (poprzez produkty pośrednie tj. alkohole, aldehydy, kwasy karboksylowe) do tlenku węgla(IV) i wody. W przypadku związków szczególnie opornych na rozkład fotodegradacja może spełniać rolę wstępnego etapu rozkładu przed biodegradacją. Wykazano bowiem, że działanie światła powoduje powstawanie częściowo utlenionych związków pośrednich, które są łatwiej dostępne dla mikroorganizmów i mogą ulegać biodegradacji [15].
Jak już wspomniano, w procesach pogłębionego utleniania, czynnikiem utleniającym są wolne rodniki hydroksylowe, które charakteryzują się wysokim potencjałem utleniającym (2,8 V). Dzięki temu utlenianie może prowadzić do całkowitego utlenienia wielu związków organicznych. Dla porównania w tabeli 1 przedstawiono wartości potencjału utleniającego dla różnych utleniaczy [26].
Tabela 1. Potencjał utleniający wybranych utleniaczy [26].
|
Utleniacz |
POTENCJAŁUTLENIANIA [V] |
|
rodnik hydroksylowy (OH•) |
2,80 |
|
tlen atomowy (O) |
2,42 |
|
ozon w środowisku kwaśnym (O3/H+) |
2,07 |
|
nadtlenek wodoru w środowisku kwaśnym (H2O2/H+) |
1,78 |
|
jon manganianowy(VII) w środowisku kwaśnym (MnO4¯/H+) |
1,69 |
Procesy fotochemiczne polegają na wspomaganiu chemicznego utleniania promieniami ultrafioletowymi i przebiegają według równań (1-3):
H2O2 + hγ → 2OH• (1)
3O3 + H2O + hγ → 4O2 + 2OH• (2)
Fe2+ + H2O2 → Fe3+ + OH– + OH• (3)
Proces fotodegradacji prowadzący do destrukcji złożonych związków organicznych można także prowadzić w obecności katalizatora, np. TiO2 (rozkład fotokatalityczny) [5]. Światło UV dostarcza fotony wymagane do przeskoku elektronu z pasma walencyjnego do pasma przewodzenia fotokatalizatora, którym najczęściej jest ditlenek tytanu, a energia fotonu zależy od długości fali. [13]
Przebieg tych reakcji jest zgodny z równaniami (4-7) [5]:
TiO2 + hv → e– + h+ (4)
H+ + H2O → H+ + .OH (5)
e– + H+ → .H (6)
•OH (•H) + związki organiczne → pośrednie produkty utleniania → CO2 + H2O (7)
Fotodegradacja związków chlorowcoorganicznych
Fotodegradacja dioksyn (PCDD) i furanów (PCDF) jest skuteczna w przypadku stosunkowo wysokich stężeń tych związków, natomiast w środowisku wodnym związki te występują w stosunkowo małych ilościach [20]. Ponadto rozkład fotochemiczny dotyczy tylko tych związków, które występują w środowisku przepuszczalnym dla promieni ultrafioletowych np. w rozpuszczalniku organicznym [10]. Skuteczność fotodegradacji chlorowcoorganicznych, w tym polichlorowanych bifenyli (PCB) zależy od stopnia schlorowania, pozycji podstawnika chlorowego w pierścieniu aromatycznym oraz rozpuszczalnika, w którym znajdują się te związki. Do fotodegradacji używa się lamp rtęciowych i lamp fluorescencyjnych emitujących światło o długości fali od 254 do 310 nm. [25]. Na rys. 1 i 2 przedstawiono odpowiednio uproszczone schematy ścieżek rozkładu tetrachlorodibenzodioksyny i tetrachlorodibenzofuranu z podstawnikami w pozycji 2,3,7,8 czyli związków o największej toksyczności (w odniesieniu do organizmów wskaźnikowych) [10].
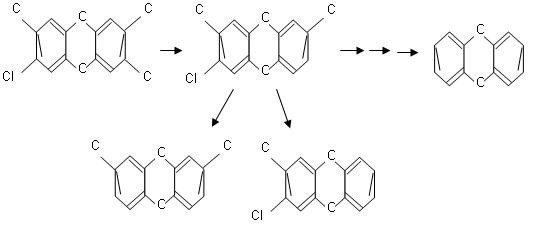
Rys.1. Uproszczony schemat fotodegradacji 2,3,7,8-PCDD [10]
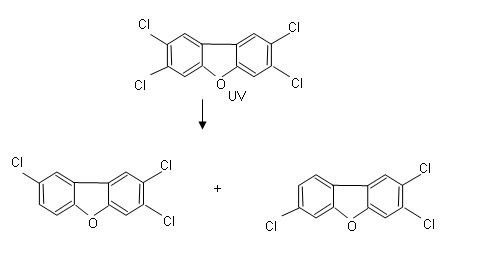
Rys. 2. Schemat fotodegradacji 2,3,7,8-PCDF [10]
Połączenie utleniania ozonem i ditlenkiem diwodoru z naświetlaniem promieniami UV zastosowano w metodzie Ultrox. Zastosowanie tej technologii pozwala na 99,99% usunięcie PCB, pestycydów, fenoli oraz PCP z wód podziemnych i ze ścieków. Z kolei utlenianie fotokatalityczne do usuwania PCDD, PCDF, PCB i innych związków organicznych chlorowanych zastosowano w technologii Nulite. Generowanie elektronów z cząsteczek związków chloroorganicznych następuje podczas naświetlania ditlenku tytanu w wodzie. Obecność wody zapewnia tworzenie aktywnych grup wodorotlenowych przechodzących w rodniki hydroksylowe. Pod wpływem rodników następuje utlenianie związków organicznych do ditlenku węgla i wody. Jednocześnie powstają jony halogenowe. Podobne procesy degradacji chloroorganicznych lecz z innym sposobem indukowania promieniowania ultrafioletowego zastosowano w technologii Laser-Induced Photohemical Oxidative Destruction. W tym procesie czynnikiem utleniającym jest ditlenek diwodoru. W skali półtechnicznej uzyskano średnio 95% ubytku takich związków jak benzen, chlorobenzen, chlorofenol, fenol i dichloroetan. Większą efektywność, sięgającą 99,8%, usuwania PCB, PCDD, PCDF oraz chlorobenzenu z odpadów uzyskano w procesie DeChlor/KGME. Odchlorowanie chlorowcopochodnych organicznych może być także wspomagane katalizatorami. Taki sposób zaproponowano do usuwania zanieczyszczeń takich jak PCDD oraz PCB z gleby i osadów dennych. Proces prowadzi się w temperaturze 340ºC w obecności odczynników chemicznych silnie redukujących i katalizujących reakcje [18].
Zastosowanie chemicznego utleniania z naświetlaniem promieniami ultrafioletowymi jest skuteczne także w usuwaniu pestycydów z roztworów wodnych. Utleniaczami są ozon lub ditlenek diwodoru, a proces może być wspomagany katalizatorami takimi jak ditlenek tytanu lub żelazo. Efektywność fotokatalitycznego utleniania aldryny badali Bandala i współpracownicy. Utleniaczem był ditlenek diwodoru, a katalizatorem ditlenek tytanu, który aktywowano używając rozproszone i skoncentrowane źródło światła. Efektywność procesu degradacji sięgała 90%. Zidentyfikowano 3 produkty pośrednie degradacji: dieldrynę, chlordan i 12-hydroksy-dieldrynę [1]. Kusvuran i Erbatur [16] do usuwania aldryny zastosowali odczynnik Fentona, ditlenek diwodoru, jony żelaza (II) także w połączeniu z ekspozycją na promienie ultrafioletowe. Badania prowadzono w odniesieniu do aldryny zaadsorbowanej na montmorylonicie lub na węglu aktywnym. Skuteczność degradacji aldryny na węglu aktywnym wynosiła 50% i była mniejsza niż na montmorylonicie, gdzie uzyskano 95% utlenienie tego związku. Na podstawie efektywności degradacji stosowane czynniki uszeregowano następująco:
UV/Fenton > UV/H2O2 > Fenton > UV/Fe2+ [16].
Efektywność rozkładu pestycydów takich jak aldryna, chlorothalonil, ametryna i appland w procesie radiacji promieniami gamma określali Dessouki i współpracownicy [7]. Podobnie jak w badaniach Kusvurana i Erbatura, proces rozkładu chlorowcoorganicznych dotyczyły związków zaadsorbowanych na granulowanym węglu aktywnym i na jonitach. Efektywność degradacji wzrastała wraz z obniżaniem się dawki promieniowania i spadkiem pH. Przy obojętnym odczynie efektywność degradacji zależała od rodzaju pestycydu i jego struktury [7]. Rozkład kwasu dichlorofenoksyoctowego (2,4-D) (będącego składnikiem pestycydów) pod wpływem promieniowania gamma w obecności ditlenku wodoru badali Drzewicz i współpracownicy. Wysoki, sięgający 90%, spadek stężenia 2,4-D uzyskano dla dawki promieniowania 1 kGy w warunkach modelowych, natomiast dla ścieków rzeczywistych największą redukcję (60%) uzyskano dla 2,4,6-trichlorofenolu (2,4,6-TCP). Zidentyfikowano produkty pośrednie rozkładu 2,4-D, którymi były 2,4-dichlorofenol (2,4-DCP), 4-chlorofenol (4-CP) oraz w śladowych ilościach – pirokatechina, hydrochinon i fenol. Wprowadzony ditlenek diwodoru zapewniał degradację nie tylko 2,4-D lecz także chlorowcopochodnych produktów pośrednich utleniania 2,4-D [8]. Rozkład chlorowcopochodnych organicznych uzyskuje się w „Technology High – Energy Electron Irradiation”. Woda zawierająca pestycydy i inne zanieczyszczenia chloroorganiczne poddawana jest wstępnie działaniu wiązki elektronów powstającej w akcelatorze. Pod wpływem rodników hydroksylowych i wodorowych następuje rozerwanie wiązania chloru lub innego halogenu z wodorem w cząsteczce. Rodnik hydroksylowy łączy się z resztą organiczną zajmując miejsce chlorowca. W wyniku rozkładu powstaje ditlenek węgla, woda i sole halogenków oraz aldehydy i kwasy karboksylowe. Kwasy karboksylowe w końcowej fazie procesu poddaje się biodegradacji [18]. Utlenianiem związków chloroorganicznych oznaczanych jako AOX w ściekach farmaceutycznych zajmowali się Höfl i współpracownicy. Stosowano chemiczne utlenianie jako proces jednostkowy oraz wspomagane promieniowaniem UV w następujących układach skojarzonych: H2O2/UV, O3/UV oraz odczynnik Fentona (H2O2/Fe(II)). Całkowitą destrukcję AOX uzyskano w procesach skojarzonych, szczególnie gdy utleniaczem był odczynnik Fentona. W procesach utleniania bez ekspozycji na promienie ultrafioletowe stopień usunięcia halogenków organicznych był mniejszy [13]. Przydatność fotokatalitycznego utleniania do usuwania związków organicznych oznaczanych wskaźnikami AOX, ChZT oraz OWO potwierdziły badania Torradesa i innych opisane przez Savanta [22]. Ścieżkę biodegradacji pentachlorofenolu (PCP) opracowała Suegara i współautorzy [23], którzy przeprowadzili badania fotodegradacji tego związku. Po 24 godzinach ekspozycji roztworu wodnego zawierającego PCP uzyskano całkowity rozkład, a jako pośrednie produkty zidentyfikowano 2,3,5,6- tetrachlorofenol, 2,3,4,6- tetrachlorofenol oraz 2,5-dichlorofenol. Na rys. 3 przedstawiono ścieżkę fotodegradacji PCP [ 23].
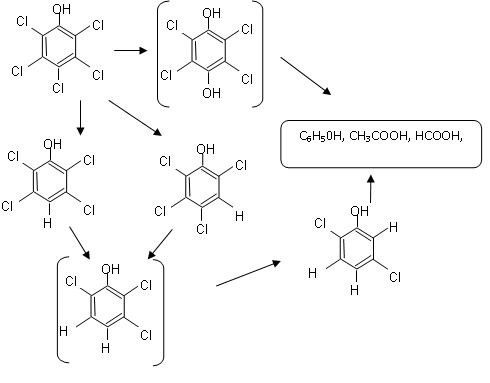
Rys. 3. Ścieżka fotodegradacji pentachlorofenolu [23]
Przeprowadzono także badania porównawcze degradacji fenolu dwoma metodami AOP: fotochemicznego i fotokatalitycznego utleniania. W wypadku degradacji fotochemicznej przy użyciu H2O2/UV zostały zidentyfikowane związki pośrednie jak benzokwinon, hydrokwinon, katechol i rezorcyna. Główną różnicą pomiędzy degradacją fotochemiczną i fotokatalityczną okazała się ilość produktów pośrednich. W przypadku fotokatalitycznego rozkładu ilość ta była niewielka, natomiast w drugim procesie produkty pośrednie były obecne w znacznych ilościach. Porównanie ekonomiki procesu fotochemicznego (H2O2/światło widzialne) i fotokatalitycznego (TiO2/światło widzialne) wykazało, że ten drugi jest bardziej ekonomiczny. Można wnioskować, że fotokataliza jest lepszym procesem z mniejszą ilością produktów pośrednich [26].
Fotodegradacja innych związków organicznych (ftalany, nonylofenole)
Podobnie jak w przypadku związków chlorowcoorganicznych, proces fotokatalitycznego utleniania zastosowano także do degradacji 2-etyloheksyloftalanów (DEHP). Katalizatorem był ditlenek tytanu, a utleniaczem ditlenek diwodoru. Efektywność degradacji określano przy różnej wartości pH, przy różnych stężeniach początkowych DEHP i różnych dawkach ditlenku diwodoru oraz zmieniającej się ilości katalizatora i różnym czasie trwania procesu. Efektywność usunięcia ftalanów wahała się w zakresie od 56 do 83% [4]. Efektywność degradacji DEHP w procesie fotokatalitycznego utleniania badali także Chung i Chen [5]. Wykazano, że efektywność degradacji fotokatalitycznej zależała od stężenia początkowego odwrotnie proporcjonalnie, natomiast wprost proporcjonalnie – od temperatury. Przy stężeniu ftalanów na poziomie 75 µg/l uzyskano 95,2% usunięcia tych związków. Chung wykazał, że skuteczność degradacji ftalanów jest wysoka przy dużych wartościach pH jak i przy małych. Wysokie pH sprzyja formowaniu jonów hydroksylowych, a następnie wolnych rodników hydroksylowych. Przy niskich wartościach pH formowane są jony H+ i zachodzące reakcje powodują formowanie wolnych rodników wodorowych. Wolne rodniki są głównymi czynnikami w fotokatalitycznej degradacji DEHP. Efektywność degradacji ftalanów zależał także od ilości katalizatora i natężenia promieniowania UV. Identyfikując produkty pośrednie degradacji opracowano ścieżki rozpadu ftalanów prowadzące do CO2 i H2O – rys. 4 [5].
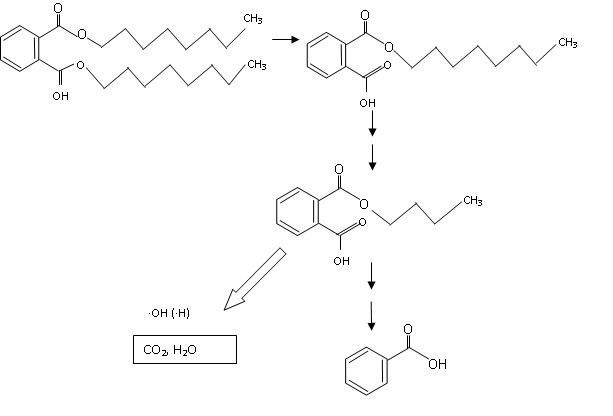
Rys. 4. Uproszczony schemat degradacji fotokatalitycznej DEHP [5]
Fotokatalityczna degradacja NPE w roztworach wodnych w obecności TiO2, jako katalizatora, powoduje degradację NPE, a produktami pośrednimi są hydroksylowane związki mono-, alkilofenole i di-etoksylaty i inne produkty o mniejszej masie cząsteczkowej. Podczas zaawansowanego utleniania następuje całkowita destrukcja struktury cząsteczek NPE [17, 28].
Fotodegradacja WWA
Węglowodory aromatyczne pod wpływem światła oraz tlenu stosunkowo łatwo ulegają reakcjom fotochemicznym tworząc związki epoksydowe, chinony, diole, fenole i aldehydy oraz pochodne zawierające azot w pierścieniu, np.: 1,5-dihydroksynaftalen, karbazol, akrydyna, 9-fluorenon, 9-hydroksyfenantren, 4-hydroksyakrydyna, ksanton, antrachinon, 1,8-dihydroksyantrachinon, 1-nitropiren. Im większa jest liczba skondensowanych pierścieni w cząsteczce WWA tym łatwiej się ona utlenia, również w wyniku reakcji substytucji elektrofilowej [19]. Na rys. 5 przedstawiono ścieżkę fotodegradacji benzenu [23].
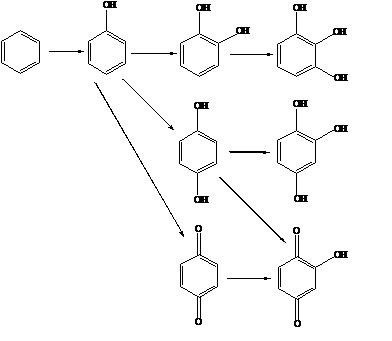
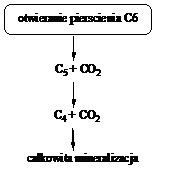
Rys. 5. Ścieżka fotodegradacji benzenu [23]
WWA ulegają destrukcji pod wpływem promieniowania ultrafioletowego o długości fali w granicach od 10 do 400 nm i elektromagnetycznego (promienie gamma o długości fali mniejszej od 124 pm) [3]. Dlatego fotodegradacja i utlenianie oraz ich połączenie są uważane za najefektywniejsze metody destrukcji WWA [11, 14]. Wpływ fotodegradacji na degradację WWA w wodach badali Xia i współpracownicy. Naświetlanie prowadzono z wykorzystaniem lampy ksenonowej. Określono rozkład acenaftenu, fluorenu, fenantrenu, fluorantenu i pirenu. Ze względu na stopień usunięcia węglowodory uszeregowano następująco:
Acenaftylen>piren>fenantren> fluoren>fluoranten
Stopień degradacji acenaftenu, fluorenu i fenantrenu spadał wraz ze wzrostem stężenia kwasów fulwowych, co wyjaśniono wspomaganiem przez kwasy powstawania aktywnego tlenu. Udział tlenu reaktywnego zwiększał stopień degradacji z 33 do 69% [27]. Skuteczność promieniowania gamma na usuwanie siedemnastu WWA badał Cataldo i współpracownicy [3]. Stosowano trzy dawki wynoszące 100, 200 i 300 kGy. Źródłem promieniowania był izotop kobaltu 60Co emitujący 2,7kGy/h. Najbardziej trwały był koronen. Na podstawie wyników badań ustalono szereg trwałości badanych węglowodorów następująco:
Koronen> chryzen>fluoren>2-metylofenantren>acenaftylen>piren>3-metylofenantren > fluoranten>fenantren>1-metylonaftalen>antracen>naftalen.
Dawka 100 kGy była wystarczająca do rozpadu większości WWA z wyjątkiem fluorenu i chryzenu. Całkowite ich usunięcie było możliwe po zastosowaniu utleniania ozonem lub mieszaniną ozonu i tlenu lub przy większej dawce promieniowania (200 kGy). Wtedy uzyskano całkowite usunięcie fluorenu i chryzenu. WWA mogą ulegać degradacji pod wpływem ozonu, ale produkty procesu radiolizy i po zastosowaniu radiolizy wraz z ozonowaniem będą różne. Wynika to z faktu utleniania pochodnych WWA, powstających po naświetlaniu, za pomocą ozonu [3]. W badaniach nad rozkładem WWA zaadsorbowanych na cząstkach popiołów lotnych stosowano naświetlanie promieniami UV. Efektywność fotodegradacji spadała wraz ze wzrostem masy cząsteczkowej WWA, a naświetlanie UV-B przyspieszało proces [21]. W odniesieniu do próbek gleby badano wpływ takich parametrów jak: temperatura, wielkość cząstek stałych, głębokość gleby i stężenie kwasów humusowych na efektywność degradacji pirenu. Czas półtrwania badanego węglowodoru zależał od głębokości warstwy gleby i gdy głębokość gleby wzrosła z 1 do 4 mm, okres półtrwania zwiększył się z 20 do 38 d. Obecność kwasów humusowych znacząco zwiększała wydajność fotodegradacji pirenu na powierzchni gleby eksponowanej na promieniowanie ultrafioletowe [30]. Jamroz i współautorzy [14] prowadzili badania utlenianie wybranych WWA z wykorzystaniem ditlenku diwodoru, ozonu oraz promieniowania ultrafioletowego. Ustalono parametry procesowe całkowitego usuwania benzo(a)pirenu, chryzenu i fluorenu w wodzie utrzymując stałą wartość pH na poziomie 7. Wykazano, że podczas fotochemicznych procesów powstawały produkty pośrednie, które wykazywały zróżnicowaną toksyczność na organizmy wskaźnikowe. Największą toksyczność odnotowano dla produktów degradacji węglowodorów, gdy do utleniania stosowano ditlenek diwodoru [14].
Podsumowanie
Źródła związków chlorowcoorganicznych w środowisku skupiają się na działalności człowieka, do których należy zaliczyć procesy spalania oraz szeroko stosowane pestycydy. Pomimo tego, że wiele składników aktywnych pestycydów zostało wycofanych z użycia lub zastąpionych innymi, to w środowisku oznaczane są dalej pozostałości tych związków, a także produkty ich rozpadu oraz przemian metabolicznych. W środowisku wodnym i glebowym (powierzchniowe warstwy) związki te ulegają rozpadowi pod wpływem promieniowania ultrafioletowego. Mechanizm ten znalazł zastosowanie w układach technicznych, gdzie naświetlanie wspomagane jest utlenianiem chemicznym z wykorzystaniem silnych utleniaczy. Efektywność rozpadu związków organicznych i ich pochodnych można zwiększyć prowadząc procesy w obecności katalizatorów. Badania wykazały, że fotodegradacja i fotokatalityczne utlenianie są skutecznymi metodami do usuwania dioksyn, furanów, polichlorowanych bifenyli, ftalanów, nonylofenoli i wielopierścieniowych węglowodorów aromatycznych z roztworów wodnych i gleby. Należy jednak zwrócić uwagę na to, że w przypadku utleniania i fotodegradacji powstają produkty pośrednie rozkładu, których toksyczność może być większa niż związków podstawowych.
Pracę wykonano w ramach BS-MN-402-305 /12
Literatura
- Bandala E.R., Gelover S., Leal M.T., Arancibia-Bulnes C., Jimenez A., Estrada C.A., Solar photocatalytic degradation of aldrin, Catalysis Today, 76, 2002, 189-199
- Bartnik A., Czarnomski K., Nowe substancje objęte postanowieniami Konwencji Sztokholmskiej oraz substancje kandydackie, Warszawa 2009
- Cataldo F., Keheyan Y., Gamma- radiolysis and ozonolysis of polycyclic aromatic hydrocarbons (PAHs) in solution, Journal of Radioanalytical and Nuclear Chemistry, Vol.267, 3, 2006, 679-683
- Chan H.W., Chan C.M., Ang P.O., Wong P.K., Integrated biosorption and photocatalytic oxidation treatment of di-(2-ethylexyl)phthalate, J.Appl. Phycol., 19, 2007, 745-753
- Chung Y.C., Chen C.Y., Degradation of di-(2-ethylexyl)phthalate (DEHP) by TiO2 photocatalysis, Water Air Pollut., 200, 2009, 191-198
- Czarnomski K., Izak E., Trwałe zanieczyszczenia organiczne w środowisku, Rozporządzenie Wspólnoty Europejskiej Nr 850/2004, Materiały informacyjne, Ministerstwo Środowiska, Wydawca Instytut Ochrony Środowiska, Warszawa, 2008
- Dessouki A.M., Aly H.F., Sokker H.H., The use of gamme radiation for removal of pesticides from wastewater, Czechoslovak Journal of Physics, 49, 1999, 521-533
- Drzewicz P., Bojanowska-Czajka A., Trojanowicz M., Kulisa K., Nałęcz-Jawecki G., Sawicki J., Listopadzki E., Degradacja pestycydu kwasu 2,4-dichlorofenoksyoctowego (2,4-D) w wodzie podczas napromieniowania γ w obecności nadtlenku wodoru, Wydawnictwo Politechniki Częstochowskiej, Konferencje 55, 2004, 161-170
- Dudziak M., Bodzek M., The effect of presence of salts on the removal of xenoestrogens in nanofiltration, Polish Journal of Environmental Studies, 2B, 2009, 14-16
- Dudzińska M. R., Kozak Z., Polichlorowane dibenzo(p)dioksyny I dibenzofurany- właściwości I oddziaływanie na środowisko, Monografie Komitetu Inżynierii Środowiska PAN, 6, Lublin 2001
- Dugay A., Herrenknecht C., Czok M., Guyon F., Pages N., New procedure for selective extraction of polycyclic aromatic hydrocarbons in plants for gas chromatographic-mass spectrometric analysis, Journal of Chromatography A., 958, 2002, 1-7
- Dz. Urz. UE seria L Nr 1582, 30.4.2004, Konwencja Sztokholmska w sprawie trwałych zanieczyszczeń organicznych z dnia 22 maja 2001 r., (Dz. U. Nr 14, poz. 76, 2009)
- Hofl C., Sigl G., Specht O., Wurdack I., Wabner D., Oxidative degradation of AOX and COD by different advanced oxidation process: A comparative study with two samples of a pharmaceutical wastewater, Wat. Sci. Tech. 4, 1997, 257-264
- Jamroz T., Ledakowicz S., Miller J., Sencio B., Toksyczność wielopierścieniowych węglowodorów aromatycznych i produktów ich rozkładu, Inżynieria i Aparatura chemiczna, 3s, 2002, 45-46
- Kot-Wasik A., Dąbrowska D. Degradacja związków organicznych w środowisku, Wydawnictwo Wydziału Chemii Politechniki Gdańskiej 2012, 700
- Kusvuran E., Erbatur O., Degradation of aldrin in desorbed system using advanced oxidation process: comparison of the treatment methods, Journal of Hazardous Materials, 106B, 2004, 115-125
- Liu H-W., Liss S., Allen D.G., The influence of anoxic conditioning of sludge on enhanced AOX (adsorbable organic halogen) removal in aerobic biological treatment systems, Wat. Sci. Tech. 2-3, 1997, 77-84
- Makles Z., Świątkowski A., Grybowska S., Niebezpieczne dioksyny, Arkady, Warszawa 2001
- Nakamiya K., Furuichi T., Ishii K., Souda I., Degradation of chlorinated dioxin in denitrifying activated sludge from leachate treatment plant of a landfill, J. Mater. Cycles waste Management, 6, 2004, 35-40
- Niu J., Chen J., Martens D., Henkelmann B., Quan X., Yang F., Seidlitz H.K., Schramm K.W., The role of UV-B on the degradation of PCDD/Fs and PAHs sorbed on surfaces of spruce (Picea abies(L) Karst) needles, Science and the Total Environment, 322, 2004, 231-241
- Niu J., Sun P., Schramm K-W., Photolysis of polycyclic aromatic hydrocarbons associated with fly ash particles under simulated sunlight irradiation, Journal of Photochemistry und Photobiology A: Chemistry, 186, 2007, 93-98
- Savant D.V., Abdul-Rahman R., Ranade D.R., Anaerobic degradation of adsorbable organic halides (AOX) from pilp and paper industry wastewater, Bioresource Technology, 97, 2006, 1092-1104
- Suegara J., Lee B-D., Espino M., Nakai S., Hosomi M., Photodegradation of pentachlorophenol and its degradation pathways predicted using density functional theory, Chemosphere, 2005, 341-346
- Tadeo J.L., Sanchez-Brunete C., Albero B., Garcia-Valcarcel A.I., Perez R.A., Analysis of emerging organic contaminants in environmental solid samples, Cent.Eur.J.Chem.,10, 3, 2012, 480-520
- Urbaniak M., Polychlorinated biphenyls: sources, distribution and transformation in the environment – a literature review, Acta Toxicol, 15, 2, 2007, 83-93
- Wąsowski J., Piotrowska A., Rozkład organicznych zanieczyszczeń w procesach pogłębionego utleniania, Ochrona Środowiska, 85, 2002, 27-32
- Xia X., Li G., Yang Z., Chen Y., Huang G.H., Effects of fulvic concentration and origin on photodegradation of polycyclic aromatic hydrocarbons in aqueous solution: Importance of active oxygen, Environmental Pollution, 157, 2009, 1352-1359
- Yuan X., Xing W., Zhuo S.P., Si W., Gao X., Han Z., Yan Z.F., Adsorption of bulky molecules of nonylphenol ethoxylate on ordered mesaporous carbons, Journal of Colloid and Interface Science, 322, 2008, 558-565
- Zepp R. G., Schlotzhauer P.F., Eviron. Sci Technol. 17,462 (1983)
- Zhang L., Xu Ch. Chen Z., Li X., Li P., Photodegradation of pyrene on soil surfaces under UV light irradiation, Journal of Hazardous Materials, 173, 2010, 168-172
*Maria Włodarczyk-Makuła, Agnieszka Obstój – Katedra Chemii, Technologii Wody i Ścieków, Wydział Inżynierii Środowiska i Biotechnologii, Politechnika Częstochowska

