Końcówki do pipet a diagnostyka Covid
Dr Brian Perry, Mettler Toledo
Laboratoria na całym świecie śpieszą się z opracowywaniem testów i terapii w związku z pojawieniem się nowego typu koronawirusa SARS CoV-2. Badania molekularne przy użyciu łańcuchowej reakcji polimerazy z odwrotną transkrypcją (RT-PCR) wymagają obecności RNA wirusa w nienaruszonym stanie. Z tego względu próbki pacjenta muszą być pobierane w sposób zapewniający najwyższe prawdopodobieństwo uchwycenia nienaruszonego RNA i muszą być przetwarzane przy użyciu wyrobów z tworzyw sztucznych i końcówek do pipet, które są oficjalnie wolne od RN-azy i inhibitorów PCR.
Niezawodne badania diagnostyczne są niezbędnym narzędziem w walce z epidemiami wirusa. W celu zidentyfikowania czynnika zakaźnego i rozpoczęcia skutecznego leczenia wymagane jest przeprowadzenie takiego badania. Badania diagnostyczne umożliwiają monitorowanie postępu infekcji w obrębie populacji oraz pomiar skuteczności podejścia związanego ze środkami zaradczymi i ochronnymi. Dokładna diagnostyka dostarcza kluczowych informacji na temat wektorów choroby – ich metod i dróg transmisji. Na przykład gdy u członków rodzin lub współpracowników osób zakażonych zostanie również rozpoznana choroba COVID-19, dowiadujemy się, że wirus może być przenoszony poprzez kontakt fizyczny we wspólnym środowisku.
Zafałszowane wyniki ujemne: dobre badanie diagnostyczne nie wystarczy, jeżeli próbka została źle pobrana
Okazuje się, że wirus SARS CoV-2 znajduje się głównie w stosunkowo niedostępnych częściach płuc i części nosowej gardła. Aby pobrać próbkę pacjenta do badania, należy włożyć długi patyczek (najlepiej patyczek higieniczny) do nozdrza i głębiej do jamy nosowo-gardłowej. Jeśli patyczek nie zostanie zaaplikowany przez doświadczonego lekarza, właściwa procedura diagnostyczna RT-PCR stosowana do identyfikacji wirusa może zostać zakłócona przez niski poziom jego obecności, co grozi pojawieniem się wyniku fałszywie ujemnego.
Ponadto wahania wiremii w czasie choroby powodują zmienność dostępności próbki wirusa.
Przy czasie inkubacji wynoszącym około dwóch tygodni wirus SARS CoV-2 może nie zostać wykryty nawet przy prawidłowym pobraniu próbki – ze względu na nieodpowiednią porę. Nawet starannie pobrane próbki pacjenta mogą z tego powodu wykazać wynik fałszywie ujemny. Co więcej, każdy przypadek uszkodzenia integralności RNA wirusa powoduje brak możliwości wykrycia wirusa podczas badania diagnostycznego.
Badania diagnostyczne oparte na RT-PCR
Wirus SARS CoV-2 (COVID-19), podobnie jak inne koronawirusy, wirus HIV, wirus ebola oraz powszechny wirus grypy typu A i B, przenosi pojedyncze pasmo RNA (kwas rybonukleinowy) w ochronnej otoczce białka lub „kapsydzie”. Wirus SARS CoV-2 i wirus grypy mają nie tylko podobny skład genetyczny, ale także ich objawy mogą być bardzo podobne, co sprawia, że odróżnienie jednej infekcji wirusowej od drugiej na podstawie zewnętrznych objawów jest bardzo trudne. Dlatego wymagane są badania diagnostyczne pod kątem obecności konkretnego wirusa. RT-PCR to badanie molekularne, które może dostarczyć specyficzne dla SARS CoV-2 sekwencje kwasu rybonukleinowego.
Odwrotna transkrypcja PCR przekształca jednopasmowe RNA w dwupasmowe komplementarne cząsteczki DNA (cDNA) w dwuetapowym procesie. Pierwszym krokiem jest odwrotna transkrypcja (RT), w której gromadzona jest odwrotność nukleotydów cząsteczek RNA wirusa jako pojedyncze pasmo cDNA. W drugim kroku PCR jest używane do wykładniczej amplifikacji dwupasmowej wersji cDNA (ds cDNA) początkowego cDNA. Po wykładniczej amplifikacji PCR DNA jest obecne w ilości wystarczającej do przeprowadzenia diagnostyki, sekwencjonowania, klonowania itp. Rysunek 1 przedstawia typowy schemat amplifikacji RT-PCR.
Dwupasmowe cDNA zawierające oryginalną sekwencję RNA wirusa jest wykorzystywane do przedstawienia oryginalnego rodzaju RNA. Jeśli wymagana jest analiza ilościowa wirusów zakaźnych RNA, RT-PCR można połączyć z techniką ilościowego oznaczania metodą PCR (qPCR), aby uzyskać qRT-PCR. Procedura ta określa wiremię pacjenta, wskazując poziom infekcji, reakcję na terapię farmakologiczną itp.
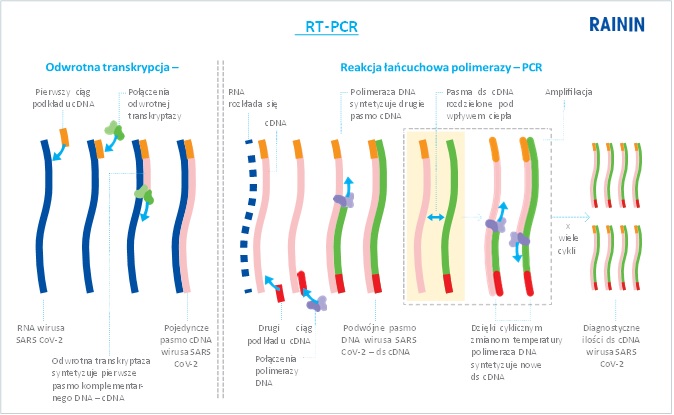
Rys. 1: W przypadku braku obecności RN-azy łańcuchowa reakcja polimerazy z odwrotną transkrypcją (RT-PCR) jest bardzo dokładną metodą wykrywania wirusa SARS-CoV-2
Aby test diagnostyczny dał wiarygodne wyniki, reakcje cząsteczkowe i enzymatyczne muszą odbywać się w czystych, wolnych od zanieczyszczeń warunkach. Oznacza to, że końcówki, rurki, płytki itp., które uczestniczą w przetwarzaniu testów, muszą być wykonane wyłącznie z czystych i najwyższej jakości materiałów oraz być pakowane w wyjątkowo czystych warunkach. Wyroby z tworzyw sztucznych muszą zostać dokładnie przetestowane przez producentów w celu zweryfikowania niewykrywalnych poziomów potencjalnych zanieczyszczeń oraz muszą być obojętne.
Dotyczy to w szczególności testów diagnostycznych polegających na obecności RNA. RNA to delikatna cząsteczka, którą łatwo zniszczyć nawet najmniejszymi śladami RN-azy. RN-azy to bardzo trwałe i agresywne enzymy, które mogą siać zniszczenie w środowisku laboratoryjnym, jeśli są obecne nawet w śladowych ilościach. Jakakolwiek rodzaj RN-azy obecny w środowisku produkcji końcówek do pipet lub opakowań albo pojawiający się w wyniku kontaktu pomiędzy ludźmi w trakcie produkcji może zagrozić wynikom testów.
Ponieważ każde diagnostyczne badanie molekularne sprawdzające obecność SARS CoV-2 jest uzależnione od obecności nienaruszonego RNA wirusa SARS CoV-2, niezwykle ważne jest przeprowadzenie badań przy użyciu końcówek do pipet, które uzyskały certyfikat potwierdzający brak wykrywalnej RN-azy.
Testowanie końcówek BioClean Ultra
Firma Rainin testuje końcówki do pipet pod kątem obecności różnych zanieczyszczeń, w tym RN-azy i inhibitorów PCR. Technika ilościowego oznaczania metodą PCR (qPCR) jest stosowana do testowania partii końcówek pod kątem obecności jakichkolwiek zanieczyszczeń, które mogłyby potencjalnie zmniejszyć dokładność RT-PCR. Testowanie końcówek BioClean Ultra firmy Rainin opiera się na najbardziej rygorystycznych testach jakości pod kątem obecności RN-azy w branży końcówek do pipet. Wielu konkurentów firmy Rainin po prostu określa swoje końcówki jako „pozbawione RN-azy” lub „wolne od -RNazy”, nie podając przy tym żadnych kryteriów testowych potwierdzających te stwierdzenia. Inni przedstawiają niekompletną charakterystykę techniczną, np. „KU (jednostki Kunitza)” lub „femtogramy (fg)”, nie wyjaśniając kontekstu ani zakresu zanieczyszczenia.

Fot.: Próbne testowanie czystości końcówek BioClean Ultra w firmie Rainin (MT)
Niektórzy konkurenci firmy Rainin nie wykonują testów pod kątem obecności inhibitorów PCR, zob. Tabela 1. Firma Rainin stosuje test inhibitora PCR jako procedurę binarną, w której amplikon albo zostaje wykryty, albo go nie ma. Dlatego też firma Rainin przekazuje wyniki testu inhibitora PCR w formie informacji „Nie wykryto”. Co więcej, proces testowania jakości BioClean Ultra firmy Rainin jest przeznaczony do regularnego sprawdzania wszystkich urządzeń i procesów montażowych w pomieszczeniu czystym. W ten sposób nieprzerwanie monitoruje jakość środowiska produkcyjnego, pozwalając upewnić się, że nie wystąpiły żadne systematyczne przypadki zanieczyszczenia.
Poniższa tabela (1) pokazuje proces badania jakości w firmie Rainin w porównaniu z wieloma firmami konkurencyjnymi.
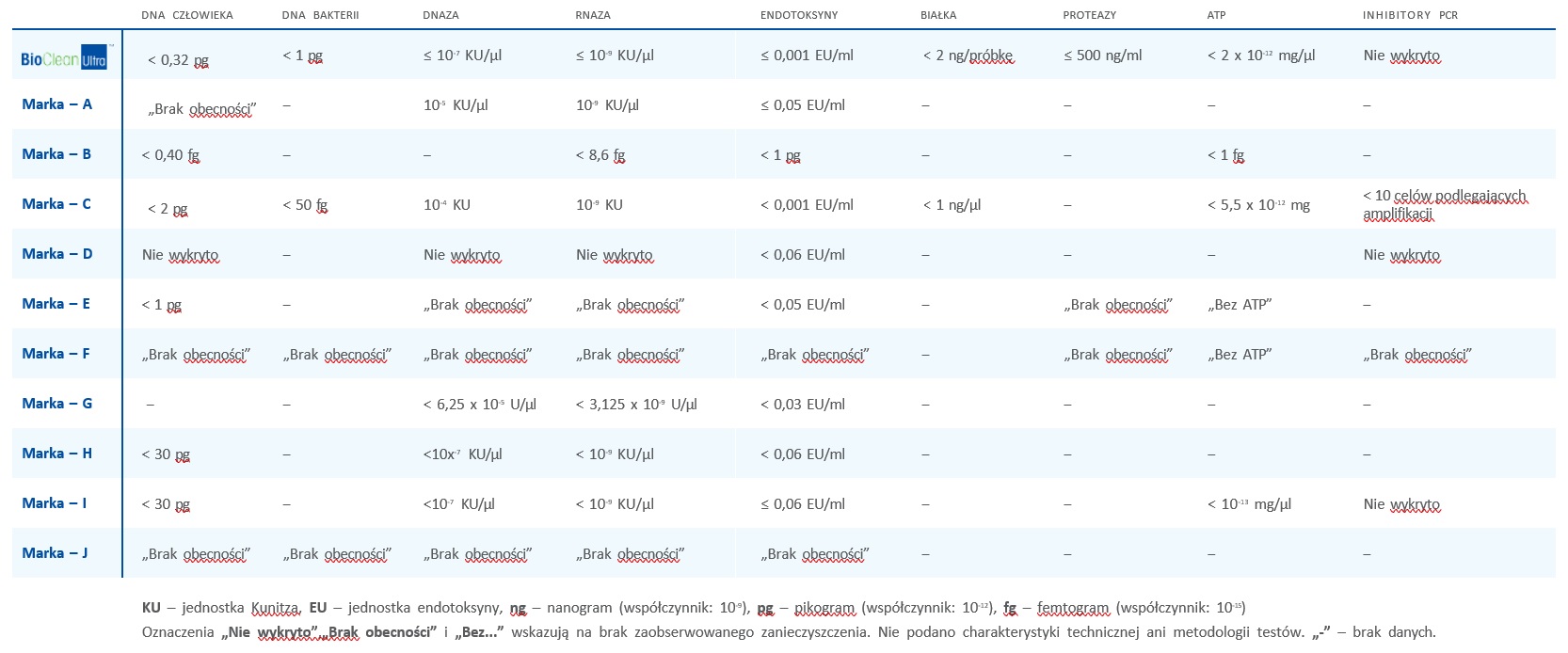
Tabela 1: Porównanie testowania zanieczyszczeń
Tabela 2 przedstawia porównanie testowania obecności RN-azy przez firmę Rainin oraz jej główne firmy konkurencyjne. Wiele firm konkurencyjnych po prostu deklaruje, że ich końcówki są „wolne od RN-azy”. W przypadku braku jakichkolwiek określonych granic wykrywalności nie ma możliwości wyciągnięcia wniosków dotyczących integralności badań. Oznacza to, że laboratoria badające obecność wirusa SARS CoV-2 mogą mieć pełne zaufanie do końcówek do pipet firmy Rainin.
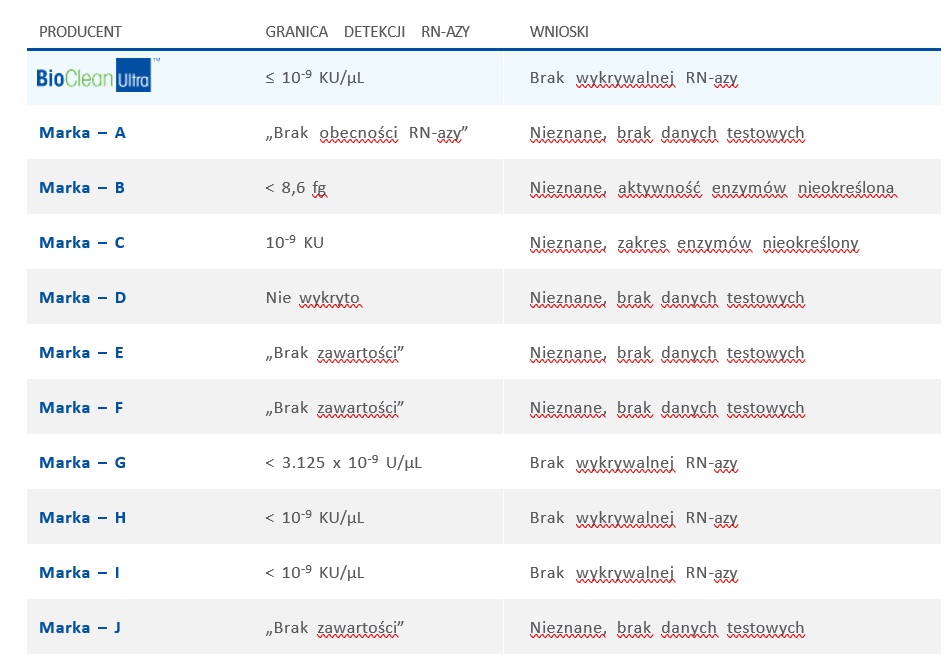
Tabela 2: Porównanie testowania obecności RN-azy
Obejrzyj filmik: Rainin BioClean Ultra Tip Rack – YouTube
Link do podpięcia do aliasu powyżej:

