Akredytacja laboratoriów wg normy PN-EN ISO/IEC 17025 w pigułce
Sytuacja na rynku usług laboratoryjnych w Polsce rozwija się dynamicznie. Aby na tym trudnym rynku utrzymać się należy przekonać potencjalnych klientów do swoich kompetencji i jakości świadczonych usług. Drogą do sukcesu może być wdrożenie systemu zarządzania w laboratorium zgodnie z normą PN-EN ISO/IEC 17025. Krótko o tym, jak to zrobić i czy warto napisano w niniejszym artykule.
Wprowadzenie
Codzienne w laboratoriach kontrolno-pomiarowych i naukowo-badawczych wykonuje się miliony analiz różnego rodzaju substancji w próbkach stałych, ciekłych i gazowych. Postęp w analityce chemicznej, rozwój i powstawanie nowych metod pomiarowych przyczynia się do gwałtownego zwiększenia zakresu jakościowego i ilościowego tych analiz. Badania nowych substancji jest domeną laboratoriów naukowo-badawczych, podczas gdy laboratoria kontrolno-pomiarowe prowadzą przede wszystkim rutynowe analizy tych substancji, których maksymalne dopuszczalne stężenia w różnych elementach środowiska jest regulowane.
Zmiany polityczno-gospodarcze, jakie mają miejsce w naszym kraju w minionych kilkunastu latach spowodowały, że z jednej strony istotnie wzrosły wymagania jakościowe w stosunku do laboratoriów kontrolno-pomiarowych, a z drugiej strony pojawiła się ogromna konkurencja na rynku nie tylko krajowym, ale i międzynarodowym. Ponadto do zmagań tych przystąpiły laboratoria naukowo-badawcze, zmuszone do poszukiwania nowych źródeł finansowania.
Dla wielu potencjalnych klientów usług laboratoryjnych najważniejszym pytaniem jest jak w tym wszystkim znaleźć rzetelnego i wiarygodnego wykonawcę naszych badań i jakie przyjąć kryteria tych poszukiwań i wyboru. Sposobem na potwierdzenie kompetencji laboratoriów wykonujących badania, pomiary i wzorcowania jest akredytacja. W przypadku laboratoriów badawczych i wzorcujących normą, która jest podstawa do uzyskania akredytacji jest norma PN-EN ISO/IEC 17025:2005 „Ogólne wymagania dotyczące kompetencji laboratoriów badawczych i wzorcujących” [1].
Laboratoria badawcze lub wzorcujące chcące utwierdzić swoją pozycję na rynku wprowadzają system zarządzania oparty o te normę, a następnie ubiegają się w Polskim Centrum Akredytacji (PCA) o certyfikat akredytacji. Czy jest to jedyna droga do potwierdzenia swoich kompetencji i pozyskania w ten sposób nowych klientów na swoje usługi i produkty? Odpowiedź można znaleźć w niezwykle ciekawym wywiadzie Dyrektora Polskiego Centrum Akredytacji – dr inż. Eugeniusza Roguskiego zamieszczonym w jednym z czasopism [2]. Pan Prezes na pytanie o sens akredytacji laboratoriów naukowych odpowiada: „Uważam, że laboratoria badawcze, w rozumieniu naukowe – w ogóle nie powinny być akredytowane, bo to ogranicza ich elastyczność. Badania w takich laboratoriach są często eksperymentalne, a wynik nie jest znany i kolejnymi przybliżeniami staramy się go ustalić.”. Ale nieco dalej dodaje „Z czegoś jednak trzeba żyć. Nie zawsze granty naukowe dają szansę utrzymania laboratoriów, czasem trzeba świadczyć usługi komercyjne”.
Najtrudniejszy pierwszy krok, czyli wdrażamy system w naszym laboratorium
Norma PN–EN ISO/IEC 17025:2005 [1] określa wymagania dotyczące opracowania systemu, jego wdrożenia, a także określa warunki, jakie muszą zostać spełnione, aby PCA uznało kompetencje laboratorium do wykonywania badań.
Przygotowania laboratorium do akredytacji można podzielić na kilka etapów:
- Przegląd aktualnego stanu laboratorium pod kątem stopnia spełniania wymagań normy PN-EN ISO/IEC 17025 [1].
- Opracowanie wykazu zmian i prac, które powinny zostać podjęte i wykonane.
- Przeprowadzenie analizy kosztów wykonania tych działań.
- Opracowanie Księgi Jakości, procedur ogólnych i badawczych i innych dokumentów związanych,
- Wdrożenie zasad postępowania i ich nadzorowanie.
- Przeprowadzanie auditów wewnętrznych.
- Zgłoszenie formalnego wniosku akredytacyjnego i poddanie laboratorium auditowi jednostki akredytującej, otrzymanie świadectwa akredytacji i jego utrzymanie.
W trakcie ubiegania się o akredytację i wdrażania systemu zarządzania w laboratorium niezwykle istotne są takie działania jak walidacja stosowanych metodyk badawczych, sterowanie jakością badań oraz obliczenia niepewności wyników badań. Te trudne i obszerne zagadnienia są opisane w literaturze, spośród której warto wymienić: „Akredytacja laboratoriów badawczych wg normy PN-EN ISO/IEC 17025 – przewodnik” [3] oraz „Ocena i kontrola jakości wyników pomiarów analitycznych” [4].
Podstawowym dokumentem dla wszystkich podmiotów akredytowanych lub ubiegających się o akredytację jest Opis systemu akredytacji (DA-01). Dokument ten i wiele innych wymienionych poniżej są dostępne na stronie Polskiego Centrum Akredytacji (www.pca.gov.pl). W dokumencie tym przedstawiono ogólne zasady i postanowienia, jakimi kieruje się Polskie Centrum Akredytacji udzielając lub nadzorując akredytację. Z kolei specyficzne wymagania akredytacyjne oraz warunki udzielania i utrzymywania akredytacji oraz szczegółowe zasady prowadzenia ocen zawarto w dokumentach: DAB-07 (dla laboratoriów badawczych), DAP-04 (dla laboratoriów wzorcujących), DAC-08 (dla jednostek certyfikujących), DAK-07 (dla jednostek inspekcyjnych), DAC-09 (dla weryfikatorów EMAS), DAC-10 (dla weryfikatorów GHG) oraz DAPT-01 (dla organizatorów badań biegłości). Prawa i obowiązki akredytowanych podmiotów opisano szczegółowo w dokumencie DA-08.
PCA udziela akredytacji na działalność laboratorium jaką są badania, pobieranie próbek oraz opinie i interpretacje. W wyjątkowych sytuacjach PCA może udzielić akredytacji na pobieranie próbek, które nie są przedmiotem badań wykonywanych w laboratorium. Warunkiem udzielenia i utrzymania akredytacji dla laboratorium jest spełnienie wszystkich wymagań akredytacyjnych określonych w dokumencie DAB-07 oraz wykonywanie badań wszystkimi metodami zgłoszonymi do akredytacji. W czasie posiadania akredytacji laboratorium powinno wykonywać badania wszystkimi metodami, na które uzyskało akredytację, co najmniej raz w okresie roku.
Laboratorium powinno przedstawić obiektywne dowody potwierdzające jego kompetencje w zakresie działalności zgłoszonej do akredytacji. W wypadku, kiedy w trakcie oceny zostanie wykazane, że dla zgłoszonej do akredytacji działalności (w całości lub jej fragmentów) laboratorium nie przedstawiło dowodów potwierdzających kompetencje, akredytacja nie zostanie udzielona. PCA nie udziela akredytacji na badania zlecane podwykonawcom. Ponadto nie jest możliwe udzielenie akredytacji na badania, wykonywane za pomocą wyposażenia pomiarowo-badawczego i/lub pomieszczeń laboratoryjnych nie będących własnością laboratorium, lub wykorzystywanych w sposób uniemożliwiający wykazanie kompetencji w obszarze działań technicznych oraz w zakresie zapewnienia poufności informacji i praw własności klienta.
Laboratorium samo określa obszar działalności, na który zamierza uzyskać akredytację, a wnioskowany zakres akredytacji przedstawia się na formularzu FAB-01 (Załącznik do wniosku o akredytację laboratorium badawczego). Przy formułowaniu zakresu akredytacji laboratorium PCA postępuje zgodnie z wymaganiami dokumentów EA-2/05 (Zakres akredytacji oraz rozważenie metod i kryteriów do oceny zakresu) oraz ILAC G18:04/2010 (Wytyczne dotyczące formułowania zakresów dla laboratoriów). W zakresie akredytacji laboratorium podaje się:
- nazwę i adres podmiotu;
- nazwę i adres laboratorium (jeżeli nazwa lub adres laboratorium są inne niż nazwa lub adres podmiotu);
- dziedziny badań;
- obiekty badań/ grupy obiektów;
- badane cechy (wielkość, która jest mierzona np. stężenie, napięcie, lub właściwość, która jest oceniana np. obecność mikroorganizmów, smak);
- metody badawcze (w tym metody pomiarowe i obliczeniowe) i ich ograniczenia.
- identyfikację dokumentów zawierających opis realizacji metod badawczych;
- osoby autoryzujące sprawozdania z badań pod względem merytorycznym (tytuł, imię i nazwisko, pełniona funkcja);
- osoby odpowiedzialne za opinie i interpretacje zamieszczane w sprawozdaniach z badań;
- informację o miejscu wykonywania badań (w siedzibie laboratorium lub u klienta).
Ocena laboratorium w procesie akredytacji polega na przeglądzie dokumentacji oraz ocenie na miejscu kompetencji laboratorium do realizacji zgłoszonej do akredytacji działalności. Laboratorium badawcze ubiegające się o akredytację PCA powinno przeprowadzić przegląd dokumentacji wdrożonego systemu zarządzania na zgodność z wymaganiami akredytacyjnymi, a wyniki przeglądu przedstawione na formularzach FAB-07 i FAB-08 powinny zostać załączone do wniosku o akredytację.
Jeżeli laboratorium we wniosku o udzielenie akredytacji (lub jej rozszerzenie) powołuje własne opracowania zawierające opis metod badawczych, konieczne jest przekazanie ich do PCA w celu umożliwienia przygotowania się audytorów (ekspertów technicznych) do oceny na miejscu. Próbka obserwowanej działalności badawczej zgłoszonej do akredytacji obejmuje jej reprezentatywny zakres z każdej techniki badawczej w zgłoszonej dziedzinie, pozwalający uzyskać dostateczny stopień zaufania co do tego, że laboratorium ma kompetencje we wnioskowanym zakresie akredytacji. Obserwacja działalności zgłoszonej do akredytacji dotyczy realizacji badań wykonywanych na rzeczywistych obiektach i w rzeczywistych warunkach. Badania wykonywane na próbkach/obiektach zachowanych do celów potwierdzenia wyników lub sterowania jakością badań uważa się za wykonywane w warunkach rzeczywistych. W wyjątkowych wypadkach dopuszcza się, za zgodą PCA, obserwację realizacji badań na próbkach/obiektach demonstracyjnych.
Laboratorium musi określić wymagania dla pracującego w nim personelu i przedstawić dowody potwierdzające jego kompetencje. Ponadto laboratorium powinno przedstawić specyficzne dowody potwierdzające właściwe realizowanie czynności przez osoby, które:
− autoryzują sprawozdania z badań,
− są odpowiedzialne za opinie i interpretacje włączane do sprawozdań z badań,
− wykonują wzorcowania wewnętrzne.
Zgodnie z pkt. 5.4 normy PN-EN ISO/IEC 17025 [1] laboratorium powinno stosować właściwe metody i procedury dla wszystkich pomiarów objętych zakresem swojej działalności. Dotyczy to zarówno pobierania próbek, postępowania z obiektami poddawanymi badaniom, ich przygotowania, przechowywania, oraz transportowania.
Laboratorium powinno stosować metody badań łącznie z metodami pobierania próbek, które spełniają wymagania klienta i są właściwe do danych badań. Zaleca się stosowanie najbardziej aktualnych wersji metod opublikowanych w normach międzynarodowych, regionalnych lub krajowych [5].
Laboratorium powinno przeprowadzić walidację metod nieznormalizowanych, metod zaprojektowanych/rozwijanych w laboratorium, metod znormalizowanych wykorzystywanych poza przewidzianym dla nich zakresem oraz metod znormalizowanych, które zostały rozszerzone lub zmodyfikowane, tak, aby potwierdzić, że metody te są właściwe do zamierzonego zastosowania. Walidacja powinna być na tyle obszerna, na ile jest to konieczne przy danym zastosowaniu lub obszarze zastosowania.
Laboratorium powinno zapisywać otrzymane wyniki, procedurę zastosowaną do walidacji oraz stwierdzenie dotyczące tego, czy metoda jest właściwa do zamierzonego zastosowania. Należy pamiętać, że zakres walidacji powinien być zawsze kompromisem pomiędzy rzeczywistymi potrzebami, a możliwościami technicznymi.
W punkcie 5.6 normy PN-EN ISO/IEC 17025 [1], opisano szczegółowo wymagania dotyczące spójności pomiarowej. Zgodnie z nimi całe wyposażenie używane do badań i/lub wzorcowań, włączając w to wyposażenie pomocnicze (np. do monitorowania warunków środowiskowych), które ma znaczący wpływ na dokładność lub miarodajność wyników badania, wzorcowania lub pobierania próbki, powinno być poddane wzorcowaniu przed oddaniem do użytkowania.
Sterowanie jakością badań to kolejne narzędzie pozwalające na utrzymanie właściwej jakości wykonywanych badań oraz doskonalenie systemu zarządzania. Laboratorium powinno opracować i udokumentować program sterowania jakością badań dla każdego rodzaju badania (metody, matrycy). Sterownie to można podzielić na wewnętrzne i zewnętrzne. Sterownie wewnętrzne jakością badań to bieżące monitorowanie badań i analiz laboratoryjnych w celu określenia poprawności i niepewności badania (np. wykorzystanie kart Shewarda), a sterowanie zewnętrzne obejmuje udział w badaniach międzylaboratoryjnych oraz badaniach biegłości.
Niepewność można określić jako parametr związany z wynikiem pomiaru, charakteryzujący rozrzut wartości, które można w uzasadniony sposób przypisać wielkości mierzonej. Niepewność jest integralną częścią każdego wyniku pomiaru i nie należy jej utożsamiać z błędem pomiaru, który dotyczy pojedynczego pomiaru i jest różnicą pomiędzy indywidualnym wynikiem, a wartością prawdziwą wielkości mierzonej. Niepewność jest przedziałem, w którym z określonym prawdopodobieństwem znajduje się wartość prawdziwa wielkości mierzonej.
Przy szacowaniu niepewności pomiaru powinny być wzięte pod uwagę wszystkie istotne składniki niepewności. Źródła składowych niepewności obejmują stosowane wzorce odniesienia i materiały odniesienia, stosowane metody i wyposażenie, warunki środowiskowe, właściwości i stan obiektów poddawanych badaniu lub wzorcowaniu oraz wykonawcę badania.
Podsumowanie, czyli czy warto było
Czy warto podejmować decyzję o wprowadzaniu systemu zarządzania w laboratorium, skoro procedury te są tak pracochłonne i często wymagają sporych nakładów finansowych? Póki co, niewiele jest laboratoriów, które czynią to dobrowolnie, a raczej działania takie wynikają z wymogów Ustawodawcy, który coraz częściej dla danego rodzaju badań dopuszczają tylko i wyłącznie laboratoria legitymizujące się certyfikatem akredytacji.
Tak jak i wszystko w życiu, akredytacja ma swoje zalety i ograniczenia. Najważniejszymi zaletami z wdrożenia i certyfikacji systemu zarządzania są:
- uporządkowanie prac laboratoryjnych i poprawa organizacji pracy,
- określenie zakresu odpowiedzialności dla poszczególnych pracowników,
- czytelnych sposoby postępowania w określonych sytuacjach,
- podnoszenie kwalifikacji personelu,
- wzrost prestiżu jednostki (laboratorium),
- zwiększenie konkurencyjności laboratorium na rynku lokalnym, krajowym i międzynarodowym.
Z kolei ograniczenia, to:
- biurokracja, czyli duża ilość dokumentów koniecznych do wypełniania i prowadzenia,
- „opór materii”, tj. niezrozumienie ze strony załogi, która mając często wieloletnie doświadczenia nagle musi coś udowadniać i prowadzić sporo papierowej dokumentacji,
- nakłady finansowe konieczne do realizacji wymaganych remontów, zakupu wyposażenia czy też późniejszego ich utrzymania;
- czas, ponieważ opracowanie i wdrożenie systemu zarządzania może być często pracochłonne.
Proces akredytacji trwa zazwyczaj około roku, aczkolwiek znane są przypadki wieloletnich starań. Czy warto tak długo się męczyć, czy może lepiej zatrudnić do tego firmę zewnętrzną, która szybko i sprawnie napisze nam całą dokumentację? Ważne jest, aby system „żył” wśród załogi laboratorium i był przez nią zarówno zrozumiały, jak i utrzymywany. A to osiąga się niestety na drodze własnych prób i błędów…
Odpowiedzią na pytanie czy warto mogą być również dwa rysunki na których zamieszczone dane o liczbie laboratoriów, którym PCA udzieliło akredytacji w latach 2005-2009 oraz o liczbie laboratoriów, które tę akredytacje utrzymały.
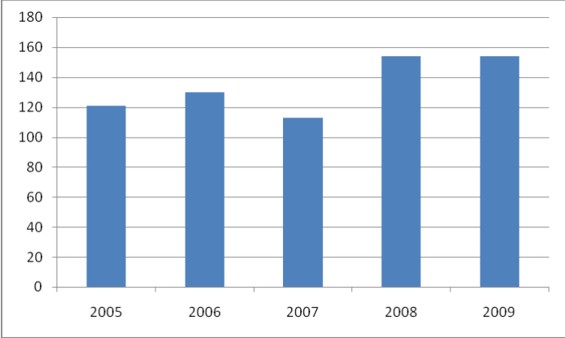
Rysunek 1 Liczba udzielonych przez PCA akredytacji w latach 2005-2009
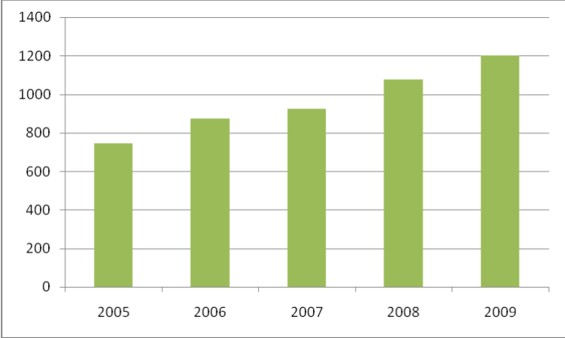
Rysunek 2 Liczba ważnych akredytacji udzielonych przez PCA w latach 2005-2009.
Literatura
- [1] PN-EN ISO/IEC 17025:2005. Ogólne wymagania dotyczące kompetencji laboratoriów badawczych i wzorcujących.
- [2] Akredytacja bez tajemnic, Laboratorium – Przegląd Ogólnopolski, 4, (2009), 6-9.
- [3] Michalski R., Mytych J., Akredytacja laboratoriów badawczych wg normy PN-EN ISO/IEC 17025 – przewodnik, wydawnictwo Elamed 2008.
- [4] Ocena i kontrola jakości wyników pomiarów analitycznych, praca zbiorowa (Bulska E., Konieczka P., Kremer E., Naganowska-Nowak A., Namieśnik J., Rompa M., Świtaj-Zawadka A., Zygmunt B.), WN-T, Warszawa 2007.
- [5] Michalski R., Normalizacja w kontroli jakości środowiska, Ekologia Przemysłowa, 1, 2010, 32-34.
* Prof. Rajmund Michalski, Śląska Wyższa Szkoła Zarządzania im. gen. J. Ziętka, Katowice
r.michalski@swsz.katowice.pl(link sends e-mail)
