Zastosowanie chromatografii gazowej do detekcji narkotyków w technice kryminalistycznej
Autor: Iwona Krzyżewska, Aleksandra Kozarska
Celem pracy jest wprowadzenie do detekcji narkotyków w technice kryminalistycznej przy zastosowaniu chromatografii gazowej. Praca przedstawia opis technik kryminalistycznych, próbek biologicznych podlegających badaniu na obecność narkotyków, proces przygotowania próbek do oznaczania oraz krótkie scharakteryzowani i podział najważniejszych środków psychoaktywnych.
Wprowadzenie
Największy wzrost obecności narkotyków i środków psychoaktywnych na świecie (głównie w Eurpie i USA był obserwowany w latach 70. minionego stulecia. Jednak, jak wynika z Europejskiego Raportu Narkotykowego, sporządzonego w 2014 roku [1], tendencja zażywania narkotyków wciąż rośnie. W wielu krajach ilość spożywanych narkotyków utrzymuje się na tym samym poziomie lecz w Polsce sprzedaż w ostatnich latach ulega ciągłemu wzostowi. Niepokojący jest fakt, iż po środki psychoaktywne najczęściej sięga młodzież w wieku szkolnym bądź studenci. Ponadto, coraz częściej spotkać można nowe związki psychoaktywne lub dopalacze, a sposób ich pozyskiwania jest coraz łatwiejszy. Przypadki przedawkowania lub ostrego zatrucia są trudne do identyfikacji, ponieważ najczęściej dochodzi do stosowania kilku związków jednocześnie. Nie jest bowiem możliwe w takiej sytuacji jednoznaczne określenie powodu zgonu lub zatrucia. Do najbardziej popularnych narkotyków wciąż należą: marihuana (49%), haszysz (28%), oraz kokaina i crack (9%). Natomiast w krajach Unii Europejskiej obserwowany jest spadek zażycia heroiny (4%). Środki psychoaktywne mają różnorodne działanie: wywołują stan zrelaksowania, senność, obojętność i brak poczucia stresu, jak również poprawiają humor. Niestety obok tych działań, obserwowane są często niebezpieczne skutki, takie jak: ból głowy, drgawki, poczucie niepokoju, wymioty, bezsenność, depersonalizacja, odrealnienie, ataksja, omamy czy oczopląs. Schemat 1 przedstawia zamknięty cykl zażywania narkotyków, ich działanie i skutki. Po działaniu relaksacyjnym i euforycznym narkotyków, pojawiają się u biorcy niebezpieczne skutki stosowania substancji psychoaktywnych, takie jak agresja, strach czy depresja. Pozornym lekiem na złe samopoczucie jest ponowne sięgnięcie po narkotyk w celu przeżycia stanu euforii i relaksu. W ten sposób cykl stosowania i działania narkotyków pozostaje zamknięty, a wyjście z nałogu staje się bardzo trudne. Narkotyki są również przedmiotem wielu przestępstw. Stosowane są w celu ułatwienia dotarcia do ofiary, pozbawienia jej świadomości oraz wprowadzenie w stan narkozy. Istotne znaczenie podczas przestępstwa ma miejsce zbrodni, stanowiące źródło mikrośladów narkotykowych [2].
Badaniem narkotyków w organizmie człowieka zajmuje się kryminalistyka. Jest to nauka łącząca ze sobą wiele dziedzin, takich jak: chemia, biologia, fizyka, czy toksykologia. Techniki kryminalistyczne obejmują bowiem badania daktyloskopowe, balistyczne oraz analizę chemiczną próbki. Jednak najważniejszym działaniem technik kryminalistycznych jest ustalenie toku postępowania sprawcy i poznanie motywu przestępstwa [2, 3, 4]. Najnowsze techniki analityczne charakteryzują się wysoką czułością, dzięki czemu jest możliwe wykrycie już niewielkich ilości narkotyków w organizmie człowieka. W tym celu stosuje się badania próbek biologicznych, jednak ze względu na dużą różnorodność związków psychoaktywnych, ich skomplikowaną budowę chemiczną i odmienne właściwości fizykochemiczne, ich oznaczenie w próbkach biologicznych jest również złożone. Najczęściej do badań stosowane są próbki biologiczne, takie jak: mocz, krew, ślina, pot, oraz włosy. Badanie zawartości narkotyków powinno odbywać się jak najszybciej po ich spożyciu, ponieważ w zależności od substancji, rozróżniane są ich odmienne czasy półtrwania [2].
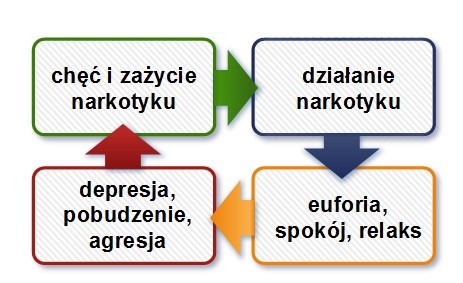
Schemat 1. Skutki działania narkotyków (opracowanie własne)
Grupy narkotyków i ich oddziaływanie na organizm ludzki
W Polsce zgodnie z ustawą z dnia 29 lipca 2005 r. o przeciwdziałaniu narkomanii [5], substancją psychotropową (psychoaktywną) jest każda substancja pochodzenia naturalnego lub syntetycznego działająca na ośrodkowy układ nerwowy, określona w wykazie substancji psychotropowych stanowiącym załącznik do tej ustawy. Według Światowej Organizacji Zdrowia (WHO) substancje te dzielą się na [6, 7]:
- alkohole,
- tytoń i nikotyna,
- opiaty (heroina, morfina),
- marihuana i haszysz,
- halucynogeny,
- kokaina,
- psychostymulanty (np. amfetaminy),
- lotne środki psychoaktywne (np. kleje),
- leki uspokajające i nasenne.
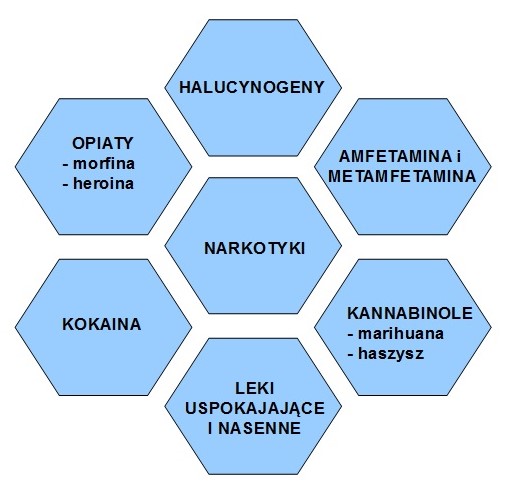
Schemat 2. Podział ważniejszych narkotyków (opracowanie własne na podstawie [3, 7])
Schemat 2 przedstawia podział ważniejszych (najczęściej stosowanych i najbardziej uzależniających) narkotyków. Do negatywnych skutków zażywania opiatów zaliczane są między innymi: senność i obojętność, a także zaburzenia świadomości. Użycie opiatów często wiąże się z odczuwaniem nadmiernej euforii, oraz zaburzeniami ze strony układu ruchu (spowolnione ruchy, zaburzenia motoryki). Morfina jest substancją najbardziej uzależniającą ze względu na silne właściwości przeciwbólowe oraz działanie na receptory centralnego układu nerwowego. Jest głównym składnikiem opium. Niewielka jej dawka, bo już 120-250 mg jest śmiertelna. Morfina w formie pierwotnej, niezmetabolizowanej jest obecna w 10% w moczu. Resztę stanowią jej metabolity (3-glukuronid, 6-glukuronid, 3-eterosiarczan oraz 3,6-diglukuronid) obecne zarówno w moczu jak i we krwi oraz w osoczu [8, 9, 10, 11, 12, 13].
Heroina natomiast również charakteryzuje się działaniem przeciwbólowym i powoduje euforię, lecz jest ono niemal dwukrotnie silniejsze niż działanie morfiny. Spowodowane jest to lepszą rozpuszczalnością w lipidach niż rozpuszczalność morfiny oraz co za tym idzie, łatwiejsze przekraczanie bariery krew-mózg. Istotnym aspektem jest fakt, iż metabolizm heroiny rozpoczyna się w organizmie już po kilku minutach. Głównymi jej metabolitami, obecnymi w moczu są: 3-O-glukuronid morfiny, 6-O-monoacetylomorfina, morfina jak również heroina w postaci pierwotnej formy. Dawka śmiertelna heroiny to zaledwie 70 mg przy dożylnym podaniu [8, 14].
Marihuana i haszysz zaliczane są do kannabinoidów, czyli substancji psychoaktywnych pozyskiwanych z konopii (Cannabis saliva). Mają one działanie stymulujące i uspokajające oraz znieczulające, dzięki obecności związku Δ9-tetrahydrokannabinolu (określanym w skrócie jako Δ9-THC). Marihuana najczęściej występuje w postaci papierosa, w którym zawartość Δ9-THC waha się od 10 do 30 mg. Palenie jej powoduje uczucie euforii, zrelaksowania oraz ogólne polepszenie samopoczucia. Haszysz natomiast zawiera kilkukrotnie większą dawkę Δ9-THC niż w przypadku marihuany a jego działania mają charakter halucynogenny, wywoływać mogą panikę i niepokój [8]. Kannabinoidy należą bowiem do grupy narkotyków zwanych halucynogenami bądź psychodelikami. Ich głównym działaniem są halucynacje i omamy. Do halucynogenów należy również popularne LSD [15, 16].
Kokaina należy do estrów ekgoniny, metanolu i kwasu benzoesowego. Charakteryzuje się szybkim tempem metabolizmu w organizmie. W handlu jest dostępna jako chlorowodorek kokainy lub jako czysta kokaina – potocznie nazywana crackiem. Niska temperatura topnienia pozwala na inhalacyjną drogę użycia tego środka, aczkolwiek może być ona stosowana również dożylnie. Jej działanie jest silnie uzależniające a szybkość reakcji odczuwalna jest w organizmie już po 20 minutach. Głównymi metabolitami obecnymi w moczu są: benzoiloekgonina, ester metylowy ekgoniny oraz forma pierwotna kokainy. 50-60% uzależnionych od kokainy łączy ją razem z alkoholem etylowym. Powstaje wówczas tzw. etylokokaina – ester etylowy benzoiloekgoniny, którego okres półtrwania jest dłuższy od samej kokainy. Stosowanie jej w dużych dawkach może powodować stany depresyjne i lękowe [8, 17, 18, 19, 20].
Amfetamina i jej pochodne powodują pobudliwość, wrażliwość i nadmierną nerwowość ale również euforię i poczucie strachu. Podobnie jak w przypadku kokainy, działanie amfetaminy jest obserwowane już po 20 minutach od zażycia, dzięki szybkiemu wchłanianiu do tkanek organizmu. Metabolity są obecne w moczu, osoczu krwi oraz w samej krwi jako: fenyloaceton, kwas hipurowy, kwas benzoesowy, 4-hydroksyamfetamina oraz sama amfetamina. Z punktu widzenia chemicznego amfetamina jest mieszaniną racemiczną D- oraz L-amfetaminy [8, 21, 22]. Pochodną amfetaminy jest metamfetamina – występująca w postaci białego proszku do użycia doustnego, donosowego lub dożylnego a także do palenia – w postaci kryształków. Działanie i szybkość działania metamfetaminy zależy od drogi przyjmowania tego środka. Najszybsze efekty działania tego związku jest przyjęcie doustne, natomiast po zapaleniu metamfetaminy, działanie jest obserwowane po kilku minutach. Podobnie jak w przypadku amfetaminy, działanie metamfitaminy polega na ogólnym pobudzeniu, euforii ale również agresji i stanów depresyjnych. Produktami metabolizmu są: amfetamina oraz 4-hydroksyamfetamina a także forma pierwotna metamfetaminy w sporej ilości (44%) [8, 23].
Działanie środków psychoaktywnych, ich metabolizm, obecność w płynach ustrojowych i próbkach biologicznych zależy od rodzaju przyjmowanej substancji, jej dawki i drogi podania. Metabolity związków psychoaktywnych są obecne bowiem zarówno w moczu, jak i we krwi, osoczu krwi oraz włosach.
Rodzaje próbek biologicznych badanych w kryminalistyce
W celu zbadania zawartości narkotyków (lub ich metabolitów) w organizmie ludzkim, w technikach kryminalistycznych stosuje się próbki biologiczne, takie jak: krew, ślina, mocz, czy włosy. Jednak istotną informacją w takim badaniu jest czas jaki minął od zażycia narkotyku.
- Mocz
W moczu znajdują się zarówno pierwotne formy narkotyków oraz ich metabolity. Obecność tych środków utrzymuje się w moczu nawet do kilku dni: opiaty, amfetamina, morfina, kodeina, kokaina i benzodiazepiny są obecne w moczu do 3 dni. Natomiast tetrahydrokannabinole aż do 5 dni (Tabela 1) [3, 24]. Ze względu na bezinwazyjność pobierania próbek, mocz jest najbardziej dogodnym źródłem informacji, jednakże sposób w jaki odbywa się operacja pobierania moczu, ciągle budzi wiele kontrowersji ze względu na pogwałcenie prywatności. W moczu zawartość substancji może jednak zostać zaburzona z powodu zmiennej ilości wypijanych płynów przez badanego. Stężenie poszczególnych substancji psychoaktywnych może być obarczone błędem w momencie różnej wartości pH moczu, przy niskim pH szybkość wydalania amfetamin wzrasta a przy zasadowym pH moczu – maleje [3, 4, 8].
- Krew
Najbardziej popularne i najczęściej stosowane jest nadal badanie próbek krwi na obecność narkotyków lub leków w organizmie człowieka. Stężenie substancji psychoaktywnych we krwi jest zróżnicowane i zależne od przyjętej dawki, masy ciała jak również stanu zdrowia badanego. Badanie krwi charakteryzuje się różnorodnością technik analitycznych. Obecność narkotyków we krwi jest krótsza niż w przypadku moczu i włosów, wynosi ona od kilku godzin (amfetamina i kannabinole do 5 godzin, opiaty i kokaina do 10 godzin, a etanol do 12 godzin) do kilku dni (benzodiazepiny do 2 dni) [3, 25, 26]. Inwazyjność metody naraża w niektórych przypadkach na zagrożenia związane ze skaleczeniem się osoby wykonującej to badanie, brakiem możliwości pobrania próbki (występująca agresja u badanego) oraz występowaniem ran i obrzęków w miejscu pobierania krwi.
- Włosy
Najbardziej nieinwazyjnym badaniem jest badanie włosów na obecność narkotyków. Na miejscu przestępstwa mają one wyższość nad innymi próbkami biologicznymi z kilku względów: są odporne na warunki atmosferyczne takie jak temperatura czy wilgotność powietrza, są odporne na działanie mikroorganizmów oraz procesy niszczenia mechanicznego. Włos składa się z cebulki, która znajduje się pod powierzchnią skóry oraz trzonu, znajdującego się na jej powierzchni. Keratyna – białko znajdujące się wewnątrz włosa, ma zdolność łączenia się z jonami metali oraz substancjami organicznymi. Badanie włosa pozwala wówczas na szczegółowe informacje na temat uzależnionego od narkotyków. Substancje psychoaktywne jak i trucizny odkładają się we włosie na konkretnych odcinkach. Długość włosa jest proporcjonalna do czasu zażywania narkotyków i dzięki temu jest możliwe stwierdzenie przyjmowania tych substancji nawet do 10 miesięcy wstecz. Ta właściwość włosów jest nazywana w kryminalistyce „szerokim oknem detekcji” (szerokim przedziałem czasu analizy) [4, 9, 25, 26, 27, 28, 29]. Jak każda metoda, analiza włosa ma również swoje wady: jest pracochłonna, kosztowna i długotrwała w porównaniu do analizy innych próbek biologicznych. Nie można zbadać zawartości narkotyków we włosach bezpośrednio po ich zażyciu, ponieważ dystrybucja substancji psychoaktywnych po tkankach i narządach a także włosach, jest stosunkowo długa. Nie uda się również oznaczenie narkotyków we włosach osoby, która zażyła narkotyki tylko jednokrotnie [4].
- Inne – ślina, pot
Do pozostałych próbek biologicznych należą między innymi ślina i pot. Charakteryzują się również prostotą i szybkością analizy a także jej bezinwazyjnością. W ślinie stężenie substancji psychoaktywnych utrzymuje się od kilku godzin (5 godzin dla amfetaminy i kanabinoli, 10 godzin dla opiatów i kokainy) aż do kilku dni (2 dni dla benzodiazepiny). W przypadku potu wartości obecnych narkotyków są zmienne i zależne od temperatury ciała, wagi, płci, wieku a także przebytych chorób [25].
Tabela 1. Czas detekcji substancji psychoaktywnych w próbkach biologicznych [3, 24]
|
Substancja |
Czas wykrycia badanej substancji w próbce biologicznej [h] |
Literatura |
||
|
krew |
mocz |
włosy |
||
|
Amfetamina i Metamfetamina |
5 b.d. |
72 72 |
Kilka miesięcy b.d. |
[3] [24] |
|
Kokaina |
10 b.d. |
72 72 |
Kilka miesięcy b.d. |
[3] [24] |
|
Opiaty |
10 b.d. |
72 72 |
Kilka miesięcy b.d. |
[3] [24] |
|
Kannabinole |
5 b.d. |
120 120 |
Kilka miesięcy b.d. |
[3] [24] |
|
Benzodiazepiny |
24 b.d. |
72 72 |
Kilka miesięcy b.d. |
[3] [24] |
W badaniu próbek biologicznych, za pomocą metod chromatografii gazowej, istotne jest również odpowiednie przygotowanie danej próbki. Metody przygotowania próbek biologicznych są różne i zależne od stężenia narkotyków w tych próbkach, rodzaju próbki biologicznej a także od rodzaju substancji psychoaktywnej. Jednak dzięki różnorodności opracowanej metody oraz wysokiej czułości aparatury, możliwe jest oznaczanie substancji psychoaktywnych na bardzo niskim poziomie detekcji.
Charakterystyka metod chromatograficznych stosowanych w technikach kryminalistycznych
Różne techniki analityczne, w tym testy immunologiczne (IA), chromatografia cieczowa (LC) oraz gazowa (GC), są stosowane do oznaczania narkotyków. Najbardziej rozpowszechnione są metody IA, lecz wykazują znacznie mniejszą czułość w porównaniu z technikami chromatograficznymi. LC wykorzystywana jest z powodzeniem w ilościowym oznaczaniu metamfetaminy (MA) oraz ketaminy (KT) i ich metabolitów w próbkach biologicznych, natomiast jej zastosowanie jest ograniczone przez wysokie zużycie rozpuszczalnika oraz czasochłonne procedury izolacji. Dla porównania GC jest szeroko wykorzystywana w celu testowania obecności narkotyków w kryminalistyce dzięki łatwości obsługi urządzenia, dużej efektywności separacji, wysokiej selektywności oraz czułości [30].
Testy na obecność narkotyków opierają się głównie na analizach krwi i moczu, natomiast w tkankach wątroby i nerek przeprowadza się badania pośmiertne. Lecz związki te wykrywane są w organizmie maksymalnie przez kilka godzin od momentu spożycia narkotyku w przypadku próbek krwi i przez kilka dni w przypadku próbek moczu. Analizy włosów są niezwykle istotne, ponieważ dostarczają wielu informacji na temat używania tych substancji w dłuższym okresie [31]. Natomiast analizy moczu pod kątem wykrywania substancji narkotycznych są proste, nieinwazyjne, a próbka dostępna jest w stosunkowo dużych ilościach. Próbki moczu zawierają stosunkowo wysokie stężenia narkotyków i metabolitów w porównaniu z innymi matrycami biologicznymi. W związku ze skomplikowaną matrycą analizowanych biologicznych próbek, w większości przypadków wymagana jest odpowiednia metoda przygotowania próbek przed analizą instrumentalną, która zapewni tez odpowiednie zatężenie wstępne badanych związków [30].
Najczęściej stosowanymi metodami wstępnego przygotowania próbek są LLE (ekstrakcja ciecz-ciecz) oraz SPE (ekstrakcja do fazy stałej). LLE jest niezwykle czasochłonna, pracochłonna oraz jest związana z użyciem dużych objętości rozpuszczalników, co często prowadzi do formowania się emulsji. Natomiast SPE jest mniej czasochłonna w porównaniu do LLE, lecz wymaga kondycjonowania kolumny oraz eluowania rozpuszczalnikami organicznymi. Obydwie techniki wymagają znacznych ilości rozpuszczalników, używanych do ekstrakcji i desorpcji, przyczyniając się do możliwości powstania niebezpieczeństwa zanieczyszczenia środowiska oraz zagrożenia dla życia ludzkiego. W ostatnich latach można zaobserwować stałą tendencję do miniaturyzowania technik przygotowania próbek, tj. zastosowanie SPME (mikroekstrakcja do fazy stacjonarnej), SBSE (ekstrakcja z wykorzystaniem ruchomego elementu sorpcyjnego), HF-LPME (mikroekstrakcja za pomocą cieczy z wykorzystaniem membrany), charakteryzujące się łatwością operacji oraz niskim zużyciem rozpuszczalnika lub też jego całkowitą eliminacją [30]. W związku z półlotnymi właściwościami wszystkich związków z grupy amfetamin, metody oznaczania tych substancji oparte na SPME mogą być prowadzone zarówno w trybie „direct-immerse” (włókno jest zanurzane bezpośrednio w badanej próbce ciekłej) lub „headspace” (włókno jest umieszczone w fazie nadpowierzchniowej, gdzie następuje podział związków organicznych pomiędzy fazę stacjonarną osadzoną na włóknie i matrycę), jak również wykorzystywane są różne rodzaje włókien [30].
Detekcja narkotyków w tkankach ludzkich
Metoda mikroekstrakcji za pomocą cieczy z wykorzystaniem membrany (HF-LPME) w trybie direct-immerse, a następnie chromatografia gazowa sprzężona z detektorem FID (detektor płomieniowo-jonizacyjny) zostały wykorzystane do ilościowego oznaczania amfetaminy (AP), metamfetaminy (MA), metylenodioksyamfetaminy (MDA), metylenodioksymetamfetaminy (MDMA), kofeiny i ketaminy (KT) w moczu osób nadużywających narkotyki. Optymalne warunki ekstrakcji obejmowały prowadzenie procesu z 30% zawartością NaCl przez 20 min., w temperaturze 30ºC, z szybkością mieszania 1000 rpm. Do analizy chromatograficznej użyto kapilarną kolumnę HP-5 (30 m x 0,53 mm średnica wewnętrzna i 1,5 µm grubość filmu), dozowanie w trybie splitless w temperaturze 250ºC. Analizę prowadzono w temperaturze detektora 300ºC, przy stałym przepływie gazu nośnego azotu na poziomie 4,0 mL/min. W tych warunkach granica wykrywalności dla analizowanych sześciu związków kształtowała się w granicach od 8 μg/L (AP, KT) do 82 μg/L (MDA), granica oznaczalności od 0,03 mg/L (AP, MA, kofeina i KT) do 0,3 mg/L (MDA), natomiast odzyski w sfortyfikowanych próbkach moczu w zakresach 75,2% do 119,3% wskazywały na doskonałą zdolność zapobiegania zanieczyszczaniu fazy ekstrakcyjnej przez matrycę oraz możliwość użycia powyższej metody w oznaczaniu ilościowym narkotyków w moczu [30].
Opiaty odgrywają istotną rolę w dziedzinie toksykologii i kryminalistyce, a ich wykrywanie w moczu i krwi jest szczególnie ważne np. w miejscach pracy, analizach toksykologicznych podczas dochodzeń oraz w badaniach osób prowadzących pojazdy. W celu oznaczania morfiny, kodeiny i 6-mono-acetylo-morfiny (6-MAM) w próbkach ludzkiego moczu i krwi opracowano metody oparte na pojedynczej derywatyzacji w fazie wodnej. Zazwyczaj, w celu detekcji powyższych związków wstępnie przeprowadza się testy immunologiczne, natomiast ze względu na ich niską specyficzność, pozytywne wyniki muszą być bezwzględnie potwierdzone technikami chromatograficznymi, gazową lub cieczową chromatografią sprzężonymi ze spektrometrią mas (GC-MS lub LC-MS). Próbki poddaje się wstępnemu przygotowaniu przed analizą z wykorzystaniem metody GC-MS. Te procedury obejmują zazwyczaj kilka kroków, między innymi hydrolizę glukoronidów w przypadku moczu czy też odbiałczania w przypadku krwi, narządów, śliny, ekstrakcję analitów z matrycy biologicznej, oraz w końcu ich derywatyzację. Morfina jest wydalana z moczem głównie w postaci 3- i 6-glukoronidów, stąd też analiza moczu na obecność całkowitej morfiny, rozpoczyna się najczęściej od hydrolizy związków sprzężonych w celu uwolnienia morfiny bezpośrednio przed procesem ekstrakcji i oznaczaniem chromatograficznym. Hydroliza może być przeprowadzana enzymatycznie lub przez dodanie silnych kwasów [32].
Próbki moczu nie poddane hydrolizie były analizowane metodą symultaniczną DLLME (dyspersyjna mikroekstrakcja w układzie ciecz-ciecz) z zastosowaniem procesu derywatyzacji (PCF). W technice tej do próbki wstrzykuje się mieszaninę rozpuszczalników: ekstrakcyjnego i dyspersyjnego. Sprzyja to formowaniu się mikro-kropel ekstrahującego rozpuszczalnika, rozproszonych w całej objętości analizowanego roztworu. Rozpuszczalnik ekstrakcyjny jest odzyskiwany z dna probówki stożkowej po odwirowaniu mętnego roztworu. Ostatecznie, zebrana faza organiczna jest bezpośrednio dozowana do układu chromatograficznego [32].
Chloromrówczan propylu (PCF) jako czynnik derywatyzujący, następnie ekstrakcja LLE i GC/MS były wykorzystywane do detekcji związków w próbkach moczu hydrolizowanego oraz we krwi. Zwalidowano metodę zarówno w przypadku próbki moczu hydrolizowanego, jak i niehydrolizowanego [32].
Separacja analitów została osiągnięta na kolumnie kapilarnej RTX-5MS (15m x 0,25mm x 0,25µm), dozowano 1µl próbki w trybie splitless w temperaturze dozownika 270ºC, przepływ gazu nośnego helu ustalono na 1,5 ml/min. Pracowano w trybie jonizacji elektronowej (EI) przy ustalonej temperaturze źródła jonów na poziomie 200ºC [32].
W przypadku moczu poddanego hydrolizie, granica wykrywalności (LOD) oraz oznaczalności (LOQ) kształtowały się odpowiednio na poziomie 2,5 ng/ml i 8,5 ng/ml dla kodeiny; 5,2 ng/ml i 15,1 ng/ml dla morfiny. Dla moczu niezhydrolizowanego, LOD i LOQ wyniosły odpowiednio: 3,0 ng/ml i 10,1 ng/ml dla kodeiny; 2,7 ng/ml i 8,1 ng/ml dla morfiny oraz 0,8 ng/ml i 1,5 ng/ml dla 6-mono-acetylo-morfiny. We krwi granicę wykrywalności i oznaczalności określono odpowiednio na poziomie: 0,44 ng/ml i 1,46 ng/ml dla kodeiny; 0,29 ng/ml i 0,98 ng/ml dla morfiny oraz 0,15 ng/ml i 0,51 ng/ml dla 6-mono-acetylo-morfiny [32].
Kodeina, 6-mono-acetylo-morfina, morfina, kokaina, metadon, ekstazy (MDMA) oraz Eve (MDE) były oznaczane w próbkach włosów z wykorzystaniem metody automatycznej ekstrakcji do fazy stałej (SPE) i chromatografii gazowej sprzężonej ze spektrometrią mas (GC/MS), prowadzonej w trybie monitorowania wybranych jonów SIM. Analiza GC/MS wymaga przeprowadzenia procesu derywatyzacji propionylowania z wykorzystaniem bezwodnika propionowego. Rozdział chromatograficzny uzyskano na kolumnie DB5MS o parametrach 15m x 0,25mm x 0,25µm. Dozowano w trybie splitless w temperaturze 270ºC. Temperatura źródła jonów i interfejsu wynosiła odpowiednio 200ºC i 280ºC [31].
Granica wykrywalności kształtowała się na poziomie 0,05 ng/mg dla opiatów i MDE oraz 0,10 ng/mg dla MDMA; 0,15 ng/mg dla kokainy oraz 0,20 ng/mg dla metadonu. Natomiast odzyski ekstrakcji ustalono pomiędzy 79 a 103%. Wartość 103% uzyskano dla morfiny prawdopodobnie w związku z niewielką hydrolizą 6-MAM [31].
W celu potwierdzenia stężeń związków, które występują blisko granicy „cut-off” (wartość graniczna, którą stężenie narkotyku musi przekroczyć, by wynik testu był uważany za pozytywny), występowania metabolitów analizowanych związków, wyeliminowania możliwości błędnej interpretacji w związku z zanieczyszczeniami zewnętrznymi, oznaczenia powtórzono z wykorzystaniem GC/MS z analizatorem masy typu pułapka jonowa w trybie pozytywnej chemicznej jonizacji (GC/IT/CI/MS). Jonizacja chemiczna (CI) to metoda niepowodująca fragmentacji cząsteczek, należy do tzw. łagodnej jonizacji (jonizacji miękkiej). Związki chemiczne tworzące grupy o stosunkowo niskim stosunku masy do ładunku, lecz wysokiej intensywności w jonizacji elektronowej, prowadzą do powstania jonów o wyższym stosunku m/z, przyczyniając się do poprawy specyficzności w jonizacji chemicznej. Przykładowo metadon, tworzący jon o masie m/z 72 w EI, w CI charakteryzuje się dwoma jonami o stosunkach m/z 310 i 265. Rozdział odbywał się na kolumnie DB5MS 15m x 0,25mm x 0,25µm, dozowano w trybie splitless. Acetonitryl przyjęto za gaz reakcyjny [31].
Próbki włosów z głowy były analizowane pod kątem pięciu stymulantów derywatów fenyloalkiloaminy: amfetaminy (AP), metamfetaminy (MA), 3,4-metylenodioksymetamfetaminy (MDMA), 3,4-metylenodioksy-amfetaminy (MDA) i 3,4-metylenodioksy-N-etyloamfetaminy (MDEA), i dwóch kannabinoidów THC (tetrahydrokannabinolu) i CBN (kannabinolu) z wykorzystaniem chromatografii gazowej sprzężonej ze spektrometrią mas z użyciem monitorowania wybranych jonów SIM i w trybie jonizacji elektronowej (GC/MS-EI). Procedura analityczna obejmuje następujące kroki: płukanie włosów przed analizą w dichlorometanie, trawienie alkaliczne w celu ekstrakcji analitów z łodygi włosa, ekstrakcja LLE kannabinoidów, SPE i derywatyzacja bezwodnikiem pentafluoropropionowym w przypadku amfetamin. Wszystkie analizy były identyfikowane i oznaczane ilościowo z wyjątkiem kannabinolu (CBN), który był tylko określony jakościowo. Każdy z ekstraktów – derywatyzowany i niederywatyzowany – był nastrzykiwany w trybie splitless do układu chromatograficznego wyposażonego w kapilarną kolumnę 30m x 0,25mm x 0,25µm, wypełnioną 5% fenylometylosiloksanem. LOQ i LOD dla grupy amfetamin kształtowały się na poziomie odpowiednio 0,2 ng/mg i 0,10 ng/mg; dla THC 0,10 ng/mg i 0,05 ng/mg; LOD dla CBN ustalono na 0,05 ng/mg [33].
Amfetamina, metamfetamina, MDA, MDMA, kokaina, benzoiloekgonina, norkokaina, kokaetylen, kodeina, morfina, 6-acetylomorfina, oksykodon, oksymorfon, hydrokodon, hydromorfon, metadon, meperydyna były oznaczane w próbkach włosów z wykorzystaniem SPE, a następnie HS-SPME-GCMS. Połączenie dwóch metod SPE i SPME umożliwiło ekstrakcję związków o charakterze zarówno kwasowym jak i zasadowym, usunięcie lipidów i białek, a także zredukowanie szumu tła. Zastosowanie niepolarnego włókna z PDMS dodatkowo zwiększyło selektywność i przyczyniło się do redukcji szumów tła [34].
Ketony (hydromorfon, hydrokodon, oksymorfon i oksykodon) są przeprowadzane w oksymy za pośrednictwem metoksylaminy. Analiza ketonów bez konwersji skutkuje bardzo niską czułością. W tym przypadku LOD na poziomie 30 ng/mg włosów jest nieakceptowalny. Wprowadzenie dodatkowego procesu znacznie zwiększyło efektywność analizy chromatograficznej, czego potwierdzeniem była wartość LOD – 0,2 ng/mg włosów [34].
Zastosowano technikę FAAST (FastAutomatedScan/SIM Technique), pozwalającą na jednoczesne zbieranie danych w trybie SCAN i SIM w pojedynczym przebiegu bez utraty czułości. Anality były identyfikowane z użyciem biblioteki widm masowych w trybie SCAN, a oznaczanie ilościowe odbywało się w trybie SIM, gwarantującym mniejsze szumy tła i łatwiejszą integrację pików. Dodatkowo zastosowanie dwóch odczynników derywatyzujących BSTFA i MSTFA z 1% TMCS zapewniało znacznie lepszy kształt pików dla wszystkich analitów oraz mniejszą wrażliwość próbki na pozostałą wilgoć, utrzymującą się po odparowaniu rozpuszczalnika organicznego [34].
Wartości odzysków różniły się znacznie w zależności od rodzaju substancji i kształtowały się w granicach od 2 do 68%. Przyczyną tego mogą być rozmaite czynniki. Jednym nich jest wybór odpowiedniego ekstrahenta. Narkotyki mogą być ekstrahowane z próbki włosów z wykorzystaniem:
– hydrolizy enzymatycznej, charakteryzującej się dobrymi odzyskami, lecz wymagającej użycia tioli;
– kwasów i zasad, lecz przyczyniającej się do hydrolizy analitów;
– metanolu odpowiedniego dla wielu lecz nie wszystkich związków narkotycznych [34].
Ze względu na fakt, iż próbki wstępnie poddawane są analizie metodą ELISA, do ekstrakcji wybrano metanol jako niezagrażający i nie wpływający w istotny sposób na prowadzenie testu immunologicznego [34].
Granica wykrywalności (LOD) była określona na poziomie 0,2 ng/mg włosów dla amfetaminy, metamfetaminy, MDA, MDMA, morfiny, kodeiny, 6-AM, oksykodonu, oksymorfonu, hydromorfonu, hydrokodonu, meperydyny i 0,13 ng/mg włosów dla kokainy, benzoiloekgoniny, kokaetylenu, norkokainy i metadonu [34].
W toksykologii i kryminalistyce analiza leków/narkotyków w tkankach przed i po utrwalaniu w roztworze formaliny stanowi istotną kwestię. Gdy analizy toksykologiczne są wymagane po miesiącach lub latach od czasu autopsji, tylko tkanki utrwalone formaliną, mogą być brane pod uwagę w tych analizach. Udowodniono, iż niektóre leki czy narkotyki ulegają dekompozycji lub konwersji do innych związków w roztworze formaliny podczas utrwalania. Dlatego też interpretacja otrzymanych wyników ilościowego oznaczania analitów wymaga szczególnej ostrożności w przypadku utrwalonych formaliną tkanek. Oznaczono poziomy stężeń związków – chloropromazyny, lewomepromazyny, prometazyny, bromazepamu, milnacipranu, metamfetaminy i MDMA – w tkankach ludzkich nerek i wątroby, które zostały zebrane podczas przypadków śmiertelnych w czasie autopsji z pozytywnym wynikiem na obecność leków/narkotyków w organizmie. Poszczególne części tkanek zostały utrwalone w roztworze formaliny na 1, 3, 6 i 13 miesięcy. Tkanki były badane pod kątem obecności związków i zmian ich stężeń przed i po utrwaleniu w formalinie z wykorzystaniem urządzenia GC-MS, pracującego w trybie EI, wyposażonego w kapilarną kolumnę HP-5MS o parametrach 30 m x 0,25 mm x 0,25 µm. Dozowanie odbywało się w trybie splitless w temp. 250ºC. Dla wszystkich próbek przeprowadzono testy potwierdzające w trybie SCAN w zakresie mas m/z od 40 do 550, natomiast oznaczenia ilościowe poparte są analizami z użyciem monitorowania wybranych jonów SIM. Roztwór otrzymany po zhomogenizowaniu próbek tkanek i po odwirowaniu, środek utrwalający czy roztwór standardowy formaliny z dodatkami wzorców wewnętrznych były poddawane procesowi ekstrakcji LLE, następnie derywatyzacji z użyciem TFAA (bezwodnik trifluorooctowy) [35].
Granica wykrywalności dla wszystkich powyższych związków wynosiła 0,03 µg/ml, z wyjątkiem bromazepamu i MDMA – dla których wartości uzyskano na poziomie 0,05 µg/ml. Odzyski były wyższe niż 50% z wyjątkiem lewomepromazyny w nerce utrwalonej w roztworze formaliny, gdzie wartość ta była nieznacznie niższa niż 50% (48,3%). W utrwalonych tkankach poziomy stężeń 5 związków – chloropromazyny, lewomepromazyny, prometazyny, bromazepamu i milnacipranu – zmniejszały się wraz z czasem trwania utrwalania. Jakkolwiek, nie zaobserwowano spadku zawartości powyższych leków/narkotyków w roztworze formaliny wraz z wydłużaniem czasu przechowywania tkanek. Ponadto, podczas utrwalania tkanek wątroby powstawały sulfotlenki chloropromazyny i lewomepromazyny. Przypuszcza się, że S-oksydacja chloropromazyny jest katalizowana przez ludzkie mikrosomy wątrobowe, głównie przez cytochrom P-450 3A. Lecz enzym ten nie jest aktywowany w utrwalonych tkankach, sugerując, że zjawisko to może być związane z chemiczną denaturacją/degradacją. Chociaż sulfotlenki reprezentują pojedynczą grupę możliwych derywatów (np. przypuszcza się, że chloropromazyna posiada 168 potencjalnych metabolitów) rozpatrywane są jako niezwykle istotne anality w ustalaniu obecności leków/narkotyków nawet w przypadku, gdy lek/narkotyk macierzysty jest niewykrywany. Obecność tych derywatów może odzwierciedlać przedśmiertną ekspozycję lub spożycie leku pierwotnego. Zaobserwowano, że stężenie leku macierzystego – chloropromazyny lub lewomepromazyny – było wyższe w 13. miesiącu aniżeli w 6. miesiącu. Ponieważ formalina jest silnym reduktorem, szczególnie w obecności zasad, utworzone sulfotlenki mogą być na powrót konwertowane do pierwotnych związków podczas procesu utrwalania w roztworze formaliny. Zjawisko może być również związane z wykorzystaniem tkanek, których właściwości nie są zupełnie homogeniczne. Nie wykryto metamfetaminy i MDMA w żadnym punkcie niezależnie od czasu trwania utrwalania i rodzaju tkanki [35].
W celu oceny ekspozycji na narkotyki in utero, w ostatnim czasie wprowadza się analizy innych niż mocz czy osocze, matryc biologicznych, m.in. na szeroką skalę i z powodzeniem wykorzystywane są włosy płodowe i smółka, które odzwierciedlają chroniczne używanie narkotyków począwszy od odpowiednio drugiego i trzeciego trymestru ciąży. Ponadto alternatywą dla analiz moczu i krwi mogą być badania łożyska, które w przypadku przerwania ciąży jest materiałem odrzucanym. Tworzenie łożyska ludzkiego zostaje zakończone w 4 miesiącu ciąży. Niektóre badania in vitro wskazują, iż tkanka łożyska może odgrywać rolę swoistego magazynu dla leków w zależności od powinowactwa analitów do tkanki, mając zdolność kierowania substancji chemicznych ze strony płodowej do macierzystej, chroniąc w ten sposób płód przed wysokim stężeniem ksenobiotyków. W wyniku tego estry etylowe kwasów tłuszczowych (FAEE) – biomarkery spożywania alkoholu przez kobiety ciężarne – nie są transportowane do płodu, ponieważ są one magazynowane, a następnie w znacznym stopniu degradowane przez łożysko ludzkie [36].
Opracowano analityczną metodę symultanicznego oznaczania ilościowego głównych narkotyków w łożysku ludzkim z wykorzystaniem ekstrakcji SPE, derywatyzacji MSTFA i techniki GC/MS. Próbki były dozowane w trybie splitless, a separację analitów przeprowadzano z użyciem kapilarnej kolumny 5% fenylo-95%-dimetylopolisiloksanowej ZB-5 o parametrach 15m x 0,25mm x 0,25µm. Dozownik i i interfejs pracował w temperaturze 280ºC. Spektrometr mas pracował w trybie jonizacji elektronowej. Metoda została zastosowana do oceny przenikania narkotyków przez łożysko u kobiet w ciąży, które dobrowolnie zdecydowały się na przerwanie ciąży podczas pierwszego trymestru ciąży [36].
Zakres stężeń kształtował się na poziomie 5-500 ng/g dla amfetaminy, metamfetaminy, MDMA, metadonu, kokainy, benzoiloekgoniny, kokaetylenu, morfiny, 11-nor-9-karboksy-delta-9-tetrahydrokannabinolu, nikotyny i kontyniny. Uzyskano odzyski na poziomie 36,2-83,7% [35].
Wnioski
Zażywanie narkotyków, ich sprzedaż i dystrybucja wciąż rośnie w krajach Unii Europejskiej. Liczba nowych substancji psychoaktywnych i dopalaczy mnoży się w zaskakującym tempie. Coraz częściej ofiarami niebezpiecznych skutków narkotyków padają młodzi ludzie w wieku szkolnym lub studenci. Ich identyfikacją i rozpoznaniem w organizmie człowieka zajmuje się kryminalistyka, łącząca ze sobą takie dziedziny nauki jak: biologia, fizyka, analityka chemiczna jak i sama chemia. Rozmaite techniki analityczne, w tym testy immunologiczne (IA), chromatografia gazowa (GC) i cieczowa (LC), są wykorzystywane do oznaczania narkotyków w matrycach biologicznych. Spośród nich na szczególną uwagę zasługuje chromatografia gazowa, która jest powszechnie używana w testach na obecność narkotyków ze względu na łatwość obsługi, wysoką skuteczność separacji oraz selektywność i dużą czułość. Użycie chromatografii gazowej sprzężonej ze spektrometrią mas w trybie monitorowania wybranych jonów SIM pozwala na otrzymanie wyników z wysoką wiarygodnością. Najbardziej popularnymi próbkami biologicznymi w oznaczaniu narkotyków są mocz, włosy, ślina oraz pot.
Literatura
[1] Europejski Raport Narkotykowy 2014. Europejskie Centrum Monitorowania Narkotyków i Narkomanii. ISBN: 978-92-9168-706-0, doi:10.2810/37581
[2] Mańczuk Małgorzata [w]: Innowacyjne metody wykrywania sprawców przestępstw. Pod redakcją Macieja Szostaka i Izabeli Dembowskiej. Wykorzystanie nowoczesnych technologii do badania włosów celem uzyskania informacji o popełnionym przestępstwie. Warszawa, 2014.
[3] Wiergowski M., Reguła K., Pieśniak D., Galer-Tatarowicz K., Szpiech B., Jankowski Z. Arch. Med. Sąd. Krym., 2007, LVII, 223-230.
[4] Szukalski B., Mirkiewicz E. Oznaczanie narkotyków w materiale biologicznym – ślinie i włosach. Alkoholizm i Narkomania 1995, 1, 18.
[5] Ustawa z dnia 29 lipca 2005 r. O przeciwdziałaniu narkomanii. Dz. U. Nr 179, poz. 1484 i 1485.
[6] Jabłoński P., Jędrzejko M. Narkotyki i paranarkotyki. Fundacja Pedagogium. Oficyna Wydawnicza ASPRA-JR, Warszawa 2010.
[7] http://www.who.int/substance_abuse/terminology/who_lexicon/en/#drug (dostęp dnia 10.03.2016r.)
[8] Wicka M, Chołbiński P, Kwiatkowska D, Pokrywka A. Wykrywanie substancji psychotropowych we krwi metodą LC/MS/MS Problemy Kryminalistyki 284(2) 2014.
[9] Chericoni S., Stefanelli F. , Iannella V., Giusiani M. Simultaneous determination of morphine, codeine and 6-acetylmorphine in human urine and blood samples using direct aqueousderivatisation: Validation and application to real cases. Journal of Chromatography B, 949– 950 (2014) 127– 132.
[10] Jones A.W., Holmgren A., Ahlner J. Concentrations of free-morphine in peripheral blood after recent use of heroin in overdose deaths and in apprehended drivers. Forensic Science International 215 (2012) 18–24.
[11] Kolmonen M., Leinonen A., Kuuranne T., Pelander A., Ojanperä I. Hydrophilic interaction liquid chromatography and accurate mass measurement for quantification and confirmation of morphine, codeine and their glucuronide conjugates in human urine. Journal of Chromatography B, 878 (2010) 2959–2966.
[12] Sverrisdóttir E., Foster D.J.R., Upton R.N., Estrup Olesen A., Lund T.M., Gabel-Jensen C., Drewes A.M., Christrup L..L, Kreilgaard M. Modelling concentration–analgesia relationships for morphine to evaluate experimental pain models. European Journal of Pharmaceutical Sciences 66 (2015) 50–58.
[13] Shokoofeh S., Homa M., Leila D., Samira D. Expression of spinal cord GABA transporter 1 in morphine-tolerant male Wistar rats. European Journal of Pharmacology 767 (2015) 77–81.
[14] Stewart A.M., Kalueff A.V. The behavioral effects of acute Δ9-tetrahydrocannabinol and heroin (diacetylmorphine) exposure in adult zebrafish. Brain Research 1543 (2014) 109 – 119.
[15] Szukalski B., Błachut D. Zmodyfikowane kannabinoidy – nowe groźne narkotyki. Problemy Kryminalistyki 268, 2010.
[16] Lai F.Y., Erratico C., Kinyua J., Mueller J.F., Covaci A., van Nuijs A. LN. Liquid chromatography-quadrupole time-of-flight mass spectrometry for screening in vitro drug metabolites in humans: investigation on seven phenethylamine-based designer drugs. Journal of Pharmaceutical and Biomedical Analysis 114 (2015) 355–375.
[17] Rodríguez-Álvarez T., Racamonde I., González-Mariño I., Borsotti A., Rodil R., Rodríguez I., Zuccato E., Benito Quintana J., Castiglioni S. Alcohol and cocaine co-consumption in two European cities assessed by wastewater analysis. Science of the Total Environment 536 (2015) 91–98.
[18] Fole A., Martin M., Morales L., Del Olmo N. Effects of chronic cocaine treatment during adolescence in Lewis and Fischer-344 rats: Novel location recognition impairment and changes in synaptic plasticity in adulthood. Neurobiology of Learning and Memory 123 (2015) 179–186.
[19] Carey R.J., Damianopoulos E.N., Shanahan A.B., Cocaine effects on behavioral responding to a novel object placed in a familiar environment. Pharmacology, Biochemistry and Behavior 88 (2008) 265–271.
[20] Viana M., Postigo C., Querol X., Alastuey A., López de Alda M.J., Barceló D., Artíñano B., López-Mahia P., Gacio D.G., Cots N., Cocaine and other illicit drugs in airborne particulates in urban environments: A reflection of social conduct and population size. Environmental Pollution 159 (2011) 1241-1247.
[21] Sun H., Calipari E.S., Beveridge T.J.R., Jones S.R., Chen R. The brain gene expressionprofile of dopamine D2/D3receptors and associated signaling proteins following amphetamine self-administration. Neuroscience 307, 253-261. 2015
[22] Amundsen E.J., Reid M.J. Self-report of consumption of amphetamines, cocaine and heroin in a survey among marginalized drug users. Science of the Total Environment 487, 740-745, 2014.
[23] Kuo C.S., Lin C-F., Hong P-K.A. Photocatalytic degradation of methamphetamine by UV/TiO2 – Kinetics, intermediates, and products. Water Research 74, 1-9, 2015.
[24] Szukalski B. Analiza środków psychoaktywnych w materiale biologicznym.Alkoholizm i Narkomania, 14(l), 151-163.
[25] Virkler K., Lednev I.K., Analysis of body fluids for forensic purposes: From laboratory testing to non-destructive rapid confirmatoryidentification at a crime scene. Forensic Science International 188, 1-17. 2009.
[26] Moore C., Marinetti L., Coulter C., Crompton K. Analysis of pain management drugs, specifically fentanyl, in hair: Application to forensic specimens. Forensic Science International 176 (2008) 47–50.
[27] Romano G., Indorato F., Spadaro G., Barbera S., Barbera N. Cocaine contamination in pubic hair: Analysis of the decontamination method. Egyptian Journal of Forensic Sciences (2014) 4, 129–136.
[28] Míguez-Framil M., Moreda-Pineiro A., Bermejo-Barrera P., Cocho J.A., Tabernero M.J., Bermejo A.M. Electrospray ionization tandem mass spectrometry for the simultaneous determination of opiates and cocaine in human hair. Analytica Chimica Acta 704 (2011) 123– 132.
[29] Suwannachom N., Thananchai T., Junkuy A., O’Brien T.E., Sribanditmongkol P., Duration of detection of methamphetamine in hair after abstinence . Forensic Science International 254 (2015) 80–86.
[30] Xiong J., Chen J., He M., Hu B. Simultaneous quantification of amphetamines, caffeine and ketamine in urine by hollow fiber liquid phase microextraction combined with gas chromatography-flame ionization detector. Talanta 82 (2010) 969-975
[31] Girod Ch., Staub Ch. Analysis of drugs in hair by automated solid-phase extraction, GC/EI/MS and GC ion trap/CI/MS. Forensic Science International 107 (2000) 261-271
[32] Chericoni S., Stefanelli F., Iannella V., Giusiani M. Simultaneous determination of morphine, codeine and 6-acetyl morphine in human urine and blood samples using direct aqueous derivatisation: Validation and application to real cases. Journal of Chromatography B 949-950 (2014) 127-132
[33] Burgueño M. J., Alonso A., Sánchez S. Amphetamines and cannabinoids testing in hair: Evaluation of results from a two-year period. Forensic Science International 265 (2016) 47-53.
[34] Aleksa K., Walasek P., Fulga N., Kapur B., Gareri J., Koren G. Simultaneous detection of seventeen drugs of abuse and metabolites in hair using solid phase micro extraction (SPME) with GC/MS. Forensic Science International 218 (2012) 31-36
[35] Uekusa K., Hayashida M., Ohno Y. Forensic toxicological analyses of drugs in tissues in formalin solutions and in fixatives. Forensic Science International 249 (2015) 165-172
[36] Joya V., Pujadas M., Falcón M., Civit E., Garcia-Algar O., Vall O., Pichini S., Luna A., de la Torre R. Gas chromatography-mass spectrometry assay for the simultaneous quantification of drugs of abuse in human placenta at 12th week of gestation.
2 aleksandrakozarska@o2.pl(link sends e-mail)
