Wykorzystanie chromatografii cienkowarstwowej
Autor: Andrzej Gierak, Agata Skorupa, Ewa Grabowska, Iwona Łazarska*
ANALIZA SUBSTANCJI BIOLOGICZNIE AKTYWNYCH
W pracy opisano wykorzystanie barwy rozdzielanych substancji w analizie chemicznej, wykonywanej metodą chromatografii cienkowarstwowej TLC. Analiza substancji metodą TLC jest stosunkowo prosta i nie wymaga skomplikowanej aparatury, natomiast jej słabą stroną jest detekcja i identyfikacja rozdzielonych substancji. W związku z powyższym autorzy pracy zwrócili szczególną uwagę na metody detekcji substancji na płytkach chromatograficznych, zwłaszcza na różnego rodzaju reakcje z rozdzielonymi, bezbarwnymi substancjami, które zarówno umożliwiają ich wykrycie, jak i możliwość identyfikacji (analizę jakościową) na podstawie ich charakterystycznej barwy. Z drugiej strony intensywność zabarwienia otrzymanych pasm chromatograficznych na płytkach TLC maja bezpośredni związek z czułością i oznaczalnością tych substancji, gdyż im bardziej intensywną barwę posiada plamka rozdzielanej substancji, tym intensywnej absorbuje kwanty promieniowania UV-VIS a tym samym umożliwia detekcje tych składników na niższym poziomie stężeń.
Metody wizualizacji pasm chromatograficznych w TLC
Analizując skład różnych mieszanin substancji za pomocą chromatografii cienkowarstwowej należy uwzględnić następujące elementy:
- przygotowanie próbki do analizy TLC;
- naniesienie badanej mieszaniny na płytkę chromatograficzną;
- dobór układu chromatograficznego;
- rozwijanie chromatografu;
- detekcja badanej substancji na płytce;
- analiza wyników (ilościowa i jakościowa interpretacja chromatogramu).
Istotną częścią analizy TLC jest ilościowa i jakościowa interpretacja chromatogramu. Bardzo często zakłada się, że substancje mające ten sam współczynnik opóźnienia Rf (wielkość charakterystyczna dla danej substancji) są identyczne. Jest to jednak nie do końca poprawne stwierdzenie. Uproszczenie to stosuje się wtedy, gdy mamy do czynienia z substancjami wzorcowymi. W takiej sytuacji współczynnik opóźnienia sugeruje nam identyfikowany związek, lecz nie daje 100% pewności identyczności obu substancji. Wykonując analizę chromatograficzną w różnych układach (zmieniając fazę ruchomą i nieruchomą) zwiększa się prawdopodobieństwo identyfikacji. Substancje można uznać za identyczne jeśli wartości ich współczynników opóźnienia Rf w różnych warunkach są takie same. Na tej zasadzie przeprowadza się analizę jakościową chromatogramu. [1,2].
Inną możliwością identyfikacji substancji może być wykorzystanie ich charakterystycznej barwy. Jeśli badana substancja po naniesieniu na warstwę chromatograficzną tworzy barwne plamki proces identyfikacji nie stwarza większego problemu, sama charakterystyczna barwa substancji może być wykorzystania do analizy jakościowej badanych składników. Do substancji barwnych, które nie wymagają wywoływania na płytce należą m.in. sole metali ciężkich, naturalne i syntetyczne barwniki, nitrofenole. Sytuacja zmienia się, gdy składniki mieszaniny nie dają na płytce widocznych plamek wówczas przeprowadza się ich wizualizację (wywoływanie chromatogramów). Wizualizacja ma na celu uwidocznienie bezbarwnych plamek, które powstały po rozwinięciu chromatogramu.
Można wykorzystać sam proces wizualizacji do selektywnego przeprowadzania identyfikowanej substancji w postać barwną, poprzez wykorzystanie odpowiedniej reakcji, zachodzącej w miarę selektywnie z oznaczanym składnikiem i dającą charakterystyczną barwę powstającego połączenia z odczynnikiem wizualizującym.
Chcąc poddać analizie składniki badanej próbki, rozwinięty i wysuszony chromatogram spryskuje się odczynnikami wywołującymi. [1-5]: Wykorzystuje się tu różne procesy wizualizacji:
- metody chemiczne;
- metody fizyczne;
- metody biologiczno – fizjologiczne;
- metody ciekłokrystaliczne.
Wizualizacja chemiczna
Wywoływanie chromatogramów metodą chemiczną polega na zwilżaniu rozwiniętej płytki różnego rodzaju odczynnikami chemicznymi. Odczynniki występujące w postaci roztworów lub aerozolów reagują ze składnikami badanej mieszaniny tworząc barwne produkty reakcji. Po spryskaniu płytki odpowiednim roztworem za pomocą rozpylaczy wizualizowane produkty reakcji mogą pojawić się od razu lub po pewnym czasie. Często płytkę dodatkowo się ogrzać w celu uzyskania oczekiwanego efektu.
Do wizualizacji stosuje się także specjalne komory chromatograficzne, w których umieszcza się odpowiednio przygotowaną płytkę z naniesioną mieszaniną. Te szczelne urządzenia wypełnione są odczynnikami chemicznymi w postaci gazowej. Są to najczęściej pary jodu bromu lub amoniaku.
Płytkę chromatograficzną można również bezpośrednio zanurzyć w odpowiednim odczynniku wywołującym. Metoda ta ma dwie podstawowe zalety: pozwala na równomierne działanie odczynnika oraz nie ma możliwości rozpylenia toksycznych związków pochodzących od substancji wizualizującej [1-4,6,23].
Niektóre odczynniki wywołujące działają destrukcyjnie (niszcząco) na powstałe plamki. W ten sposób działają m.in. substancje utleniające np. stężony kwas siarkowy (VI). Po spryskani płytki tym odczynnikiem i ogrzaniu następuje zwęglenie analitu. Metoda ta jest dość drastyczna i nie należy jej stosować w przypadku, gdy chcemy przeprowadzić dalszą analizę.
Przykładem metod niedestrukcyjnych jest umieszczenie płytki chromatograficznej w atmosferze par jodu. W ten klasyczny sposób można wywoływać związki organiczne np. pyretroidy – naturalne i syntetyczne środki ochrony roślin, należące do trzeciej generacji insektycydów [5].
Podział chemicznych odczynników wizualizujących
Podział odczynników używanych do wizualizacji chemicznej przedstawia się następująco:
- uniwersalne;
- grupowe;
- specyficzne.
Odczynniki uniwersalne wchodzą w reakcje z licznymi substancjami należącymi do różnych grup i klas związków chemicznych. Przykładem tego typu substancji jest odczynnik Dragendorffa o wzorze K[BiJ4]. Odczynnik ten służy do wizualizacji alkaloidów oraz wielu innych związków wykazujących charakter zasadowy. Na chromatogramie obserwuje się wówczas plamki na jasnożółtym tle. Odczynnik ten wywołuje także na płytce witaminę B1 w postaci fioletowej plamki [1,6,7].
Do odczynników uniwersalnych zalicza się też roztwór nadmanganianu potasu w stężonym kwasie siarkowym lub w wodorotlenku sodu. Nadmanganian potasu utlenia wiele substancji, a efektem tego utleniania jest pojawienie się na płytce brązowych plamek na fioletowym tle [1].
Plamki o żółtym lub brązowym zabarwieniu powstają na skutek działania na związek parami jodu lub ewentualnie jego alkoholowym roztworem. Metoda ta jest bardzo szybka i ekonomiczna. Pary jodu umożliwiają detekcję kwasów tłuszczowych, estrów kwasów tłuszczowych, antyoksydantów, antybiotyków, detergentów, a także już wcześniej wspomnianych pyretriodów. Pyretroidy są insektycydami, które po rozwinięciu w odpowiednim układzie chromatograficznym, umieszczeniu w komorze z parami jodu, usunięciu nadmiaru jodu i spryskaniu roztworem o – toluidyny powodują powstanie na płytce chromatograficznej ciemnoniebieskich plam na białym tle [1,5].
Często stosowanymi odczynnikami wizualizującymi monohydroksylowe fenole są [8]:
- błękit bromotymolowy
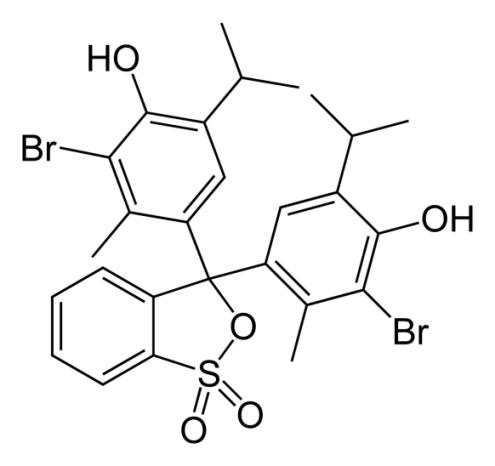
- zieleń bromokrezolowa
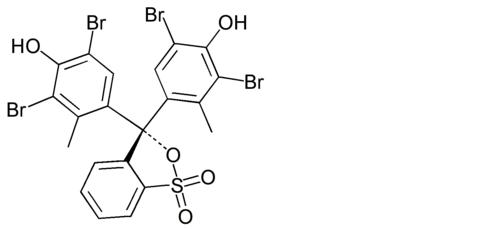
- błękit brylantowo – krezolowy
Zarówno błękit bromotymolowy, zieleń bromokrezolowa jak i błękit brylantowo – krezolowy, będący jednocześnie wskaźnikiem redoksometrycznym bardzo dobrze identyfikują fenole monohydroksylowe. Należy zauważyć, że detekcja poszczególnych związków nie zależy tylko od sposobu wizualizacji, ale też od fazy stacjonarnej, pokrywającej płytkę TLC. W przypadku monohydroksylowych fenoli najkorzystniejszą fazą stałą okazał się żel krzemionkowy [8].
Związki, które w swojej budowie zawierają atomy azotu (alkaloidy, ketostereoidy, tiole, IV‑rzędowe związki amonu, witaminy D3, K1 i B1) bardzo skutecznie są wywoływane za pomocą jodoplatynianu [6].
Terpeny we fragmentach roślin wykrywa się za pomocą aldehydu anyżowego:
- Aldehyd anyżowy
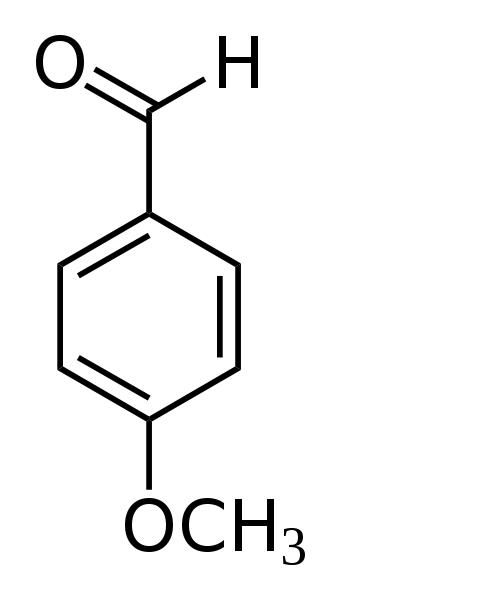
W wyniku działania tego uniwersalnego odczynnika na płytce pojawiają się czerwone strefy chromatograficzne [5,6,8].
Odczynniki specyficzne reagują wyłącznie z jednym lub kilkoma związkami chemicznymi, natomiast odczynniki grupowe z jakąś określoną grupą związków. Do specyficznych odczynników należy m.in. ninhydryna:
- Ninhydryna
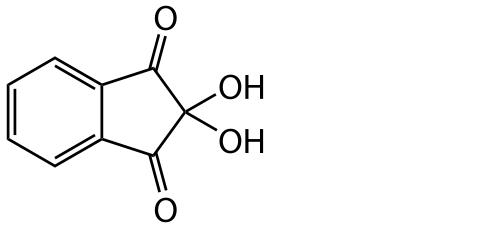
Związek ten, a dokładnie jego alkoholowy roztwór służy do wywoływania chromatogramów głównie aminokwasów. Ponieważ aminokwasy stanowią grupę związków, ninhydrynę można zaliczyć do specyficznych odczynników grupowych, wizualizujących również aminy alifatyczne, aminocukry, peptydy (liniowe), a także białka. Na chromatogramie obserwuje się wówczas żółtobrązowe, przechodzące w fioletowo-różowe strefy, które bardzo szybko zanikają. Ninhydryna służy także do identyfikacji antybiotyków: amoksycyliny, cefaleksyny, ampicyliny, kloksacyliny, gentamycyny i ko‑trymoksazolu [10-13].
Kolejnym przykładem tego typu substancji jest 2,4 – dinitrofenylohydrazyna:
- 2,4 – dinitrofenylohydrazyna
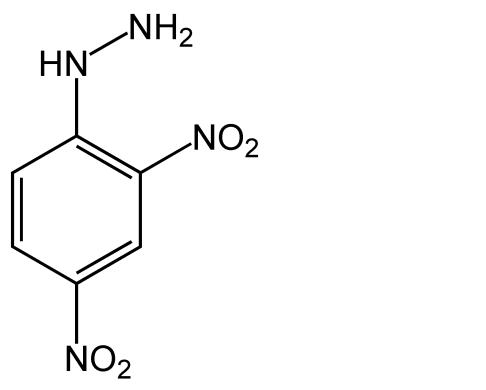
W środowisku kwaśnym związek ten daje specyficzne reakcje, mające na celu wizualizację aldehydów, ketonów oraz węglowodanów. Po użyciu tego odczynnika i wygrzaniu płytki w odpowiedniej temperaturze, powstają żółte (ewentualnie pomarańczowożółte) hydrazony lub osazony (w przypadku węglowodanów) [6].
W literaturze opisano wiele prac, w których przedstawiono konkretne związki i sposoby ich detekcji. Pyka i współpracownicy [12] wprowadzili 18 nowych odczynników wizualizujących składniki olejków eterycznych. Do składników tych należały takie związki jak: aldehydy, ketony, alifatyczne i monocykliczne alkohole, węglowodory, fenole oraz etery. Dotychczas powyższe substancje były wywoływane 5% roztworem dichromianu potasu w 40% kwasie siarkowym, 1% roztworem waniliny, 5% kwasem azotowym w stężonym kwasie siarkowym(VI), parami jodu lub bromu, chlorku antymonu(III), chlorku antymonu(V), fluoresceiny, a także odczynnikiem Emersona. Pyka i współpracownicy [12] zaproponowali, aby omawiane związki wywoływać m.in. za pomocą 0,1% kwasu solnego lub jego mieszaniny z 1% Ni(NO3)2, nasyconym roztworem chlorowodorku 4-aminodifenyloaminy, 2% CuSO4. Nowy system wizualizujący został porównany z detekcją tych związków za pomocą klasycznych metod, stosując pary jodu i uniwersalny odczynnik wywołujący – 5% roztworu K2Cr2O7 w 40% H2SO4. Omawiane badania dotyczyły analizy jakościowej, która opierała się na porównaniu współczynników opóźnienia Rf i barw powstałych plamek [12].
Reakcje chemiczne wykorzystywane do wizualizacji
Jest wiele reakcji chemicznych, których efektem są barwne produkty. Z tego też powodu są one użyteczne do wizualizacji chemicznej. Do takich reakcji zalicza się:
- reakcje utleniania i redukcji
– reakcje spalania
- reakcje kompleksowania
- reakcje nitrowania
- reakcje diazowania
Reakcje utleniania i redukcji są najczęściej stosowanymi reakcjami do wizualizacji chemicznej. Już wcześniej wspomniany jako odczynnik uniwersalny roztwór nadmanganianu potasu w stężonym kwasie siarkowym(VI) lub wodorotlenku sodu utlenia liczne substancje chemiczne. Dzięki temu na chromatogramie obserwuje się brązowe plamki na fioletowym tle [1,2].
Podobne właściwości wykazuje 5% roztworu K2Cr2O7 w 40% H2SO4, który również utlenia wiele substancji. Odczynnik ten służy m.in. do wykrywania antybiotyków: erytromycyny, streptomycyny, tetracykliny oraz doksycykliny. Zastosowaniem chromatografii cienkowarstwowej do badania antybiotyków zajmowali się Husain i jego współpracownicy [9]. Jako eluent zastosowali oni mieszaninę trichlorometanu, metanolu i amoniaku w stosunku 1:1:1, zaś fazą stacjonarną był krzemian tytanu(VI) –nieorganiczny wymieniacz jonowy.
Amoniakalny roztwór azotanu srebra to słaby utleniacz reagujący z reduktorami, głównie związkami siarki i fenolu tworzący na płytce plamki w kolorach od pomarańczowego do czarnego.
Omawiając reakcje utleniania stosowane do detekcji poszczególnych substancji należy wspomnieć o odczynniku Emersona, który identyfikuje aryloaminy, fenole, etery, aldehydy, ketony, węglowodory i wiele innych związków.
Do utleniaczy zalicza się też chloro-o-toluidyna wywołująca witaminy B1, B2, B6. Chloro-o-toluidynę stosowano również do wykrywania pozostałości środków owadobójczych w pszenicy [5,6].
Oprócz reakcji utlenienia w TLC są stosowane reakcje redukcji. Do tych reakcji szczególnie użyteczny jest kwas fosforomolibdenowy, który wizualizuje lipidy, fosfolipidy oraz niektóre stereoidy. Kwasy organiczne natomiast zawierające witaminę C są wywoływane przez odczynnik Tillman’a [1,2].
W mięsie drobiowym występują takie związki jak nitroimidazole. Jednym ze sposobów ich identyfikacji jest redukcja grup nitrowych za pomocą fluoropochodnej fluorescaminy [15].
Omawiając reakcje utleniania i redukcji należy także wspomnieć o reakcjach spalania. Najbardziej popularną substancją zwęglającą są pary stężonego kwasu siarkowego(VI). Jest to bardzo drastyczny sposób detekcji, gdyż stosując ten odczynnik niszczy się chromatogram. Następuje zwęglenie analitu co uniemożliwia dalszą analizę. Metoda ta charakteryzuje się małą czułością. Należy pamiętać, że pary stężonego kwasu siarkowego są szkodliwe dla zdrowia [1,2,12].
Kolejna grupą reakcji przydatnych w wizualizacji chemicznej są reakcje kompleksowania. Znaczna ilość kompleksów metali przejściowych jest barwna. Fakt ten związany jest z pochłanianiem światła w zakresie widzialnym przez te substancje. Pochłaniane światło ma częstość odpowiadającą różnicy poziomów energetycznych elektronu, który bierze udział w przejściu ze stanu podstawowego do wzbudzonego. Kolorowe związki kompleksowe bardzo chętnie tworzą jony miedzi(II) z kwasami karboksylowymi zawierającymi kwas tioglikolowy i kwas ditioglikolowy.
Jony te są również stosowane do detekcji białek (reakcja biuretowa). W reakcji białka z wodorotlenkiem miedzi(II), który powstał z NaOH i CuSO4, powstaje związek kompleksowy o barwie różowo-fioletowej. Metoda ta jest charakterystyczna dla związków zawierających wiązanie peptydowe [6,16].
Do wywoływania większości kwasów używa się 5–hydratu siarczanu miedzi(II). Na płytkach chromatograficznych obserwuje się wówczas niebieskie plamki na błękitnym tle [6].
Reakcje nitrowania są przydatne do wizualizacji większości związków organicznych. Nitrowanie przebiega najczęściej z użyciem par stężonego kwasu azotowego(V). Wygrzaną w odpowiedniej temperaturze płytkę z rozwiniętym chromatogramem umieszcza się w szczelnej komorze nasyconej parami tego kwasu. Na chromatogramie pojawiają się żółte lub brązowe plamki. Dalszą detekcję prowadzi się w świetle UV. Niektóre związki takie jak cukry, testosteron czy efedryna po wcześniejszym wzbudzeniu przez długofalowe promieniowanie UV po nitrowaniu fluoryzują na żółto lub niebiesko [6].
Działając stężonym kwasem azotowym(V) na roztwór białka zachodzi nitrowanie pierścieni aromatycznych obecnych w niektórych resztach aminokwasów białkowych. Białko w tej reakcji powszechnie znanej jako reakcja ksantoproteinowa barwi się na żółto. Intensywność zabarwienia zwiększa się po dodaniu zasady sodowej. Za pomocą reakcji ksantoproteinowej wykrywa się białka [10,16].
Ze względu na to, że barwniki azowe są bardzo silnie zabarwione, reakcje diazowania znalazły zastosowanie w wizualizacji chemicznej. Na tych reakcjach opiera się działanie odczynnika Brattona–Marshalla i odczynnika Pauly’sa. Za pomocą odczynnika Brattona–Marszala identyfikuje się aminy aromatyczne, mocznik, sulfonamidy, środki owadobójcze. Zaś do wywoływania kwasów karboksylowych, fenoli, amin, pochodnych imidazolu używa się odczynnika Pauly’sa. Zaletą tej metody jest długotrwałe utrzymywanie się barw na chromatogramie [6].
Wspomniane barwniki azowe mogą być otrzymywane z fenoli przez reakcje z kwasem sulfanilowym w obecności azotanu (III) sodu oraz z amin aromatycznych (nitrozwiązki redukuje się do aryloamin, nitruje azotanem (III) sodu – związki te w połączeniu z fenolami dają azobarwniki) [6,16].
Reakcje indukowane
Specyficznym rodzajem reakcji wykorzystywanych w TLC do detekcji poszczególnych związków chemicznych jest reakcja indukowana jodo–azydkowa, którą przedstawia równanie:
I2 + 2N3– induktor→ 2I– + 3N2
Kazimierczak i współpracownicy [17] zastosowali powyższą reakcje do identyfikacji aminokwasów, w skład, których wchodziły atomy siarki. W ten sposób przeprowadzano detekcje metioniny, cysteiny, cystyny oraz wybranych niebiałkowych aminokwasów. Metoda polegała na spryskaniu płytki chromatograficznej roztworem azydku sodu i skrobi, następnie umieszczeniu jej w komorze jodowej. Na chromatogramie widoczne były wówczas białe plamki na niebiesko-fioletowym tle. Okazało się, że cystyna i cysteina mogą łatwo indukować omawiana reakcję w przeciwieństwie do pozostałych aminokwasów i grup amin biogennych, które tej zdolności nie posiadają. Związki te niebędące induktorami reakcji jodo–azydkowej przeprowadza się w pochodne (spełniające warunki induktora) podczas derywatyzacji. Odczynnikiem używanym do tego procesu jest fenyloizotiocyjanian reagujący z grupa aminową. Otrzymane pochodne fenylotiokarbamylowe mogą spełniać rolę induktorów. Niestety granica wykrywalności badanych związków jest dużo niższa w porównaniu do konwencjonalnych metod wizualizacji stosowanych w TLC [17-21].
Do niedawna twierdzono, że induktorami omawianej reakcji mogą być tylko związki, w skład których wchodzi atom siarki. Badania naukowców udowodniły, że nie tylko takie związki indukują reakcję jodo-azydkową. Induktorami reakcji mogą być także pochodne fosforoorganiczne. [20,21]
Wizualizacja fizyczna
Oprócz chemicznych metod detekcji w TLC stosuje się również wizualizacje fizyczną. Dzięki temu, że jest to metoda niedestrukcyjna badaną próbkę można zachować do dalszej analizy. W wizualizacji fizycznej wykorzystuje się głównie fosforescencyjne, fluorescencyjne oraz absorpcyjne właściwości badanych związków, w stosunku do promieniowania elektromagnetycznego. W analizach środowiskowych najczęściej stosowanymi metodami fizycznymi są [1-4]:
- metody optyczne
- metody radiometryczne
Metody optyczne
Metody optyczne dotyczą oddziaływań analitu ze światłem. Do tego rodzaju metod zalicza się:
- fluorescencję
- fosforescencję
- fotometrię absorpcyjną
Jednym z najbardziej rozpowszechnionych sposobów detekcji jest detekcja UV, w której stosuje się lampy emitujące to promieniowanie. Lampy nadfioletowe mogą wysyłać światło nadfioletowe krótkofalowe (254 nm) lub długofalowe (366 nm). Niektóre płytki chromatograficzne pokrywa się warstwą sorbentu impregnowanego fluoresceiną – czynnikiem fluoryzującym. W takim przypadku cała płytka fluoryzuje pod wpływem promieniowania o określonej długości fali. Na chromatogramie pojawiają się wtedy ciemne plamki pochodzące od substancji, które wygaszają fluorescencję lub emitują światło innej długości fali niż czynnik fluoryzujący.
Jeśli płytka nie zawiera wskaźnika fluoryzującego oznaczonego zazwyczaj symbolem (F254) ewentualnie (F254+366), wtedy stosując lampy UV można prowadzić identyfikację związków, które fluoryzują pod wpływem tego promieniowania. Fluorescencję można wzbudzić lub zwiększyć jej intensywność spryskując płytkę odpowiednim odczynnikiem. Wykrywane składniki mieszaniny reagują z odczynnikiem, a produktami reakcji są substancje wykazujące zdolność fluorescencji.
Chcąc rozdzielić promieniotwórcze izotopy trzeba płytkę chromatograficzną wizualizować za pomocą błony światłoczułej, którą można zastosować do wszystkich rodzajów adsorbentów. Metoda polega na przykładaniu błony do płytki i wywołaniu jej po odpowiednim czasie ekspozycji. W taki sposób otrzymuje się odwzorowanie chromatogramu [1,2,4,6,23,24].
Sherma [23] przedstawił w swojej pracy sposoby wizualizacji kilku grup związków. Po naświetleniu płytki lampą UV można zidentyfikować niektóre alkaloidy, pestycydy czy flawonoidy. Zawarte w drobiu nitroimidazole wizualizuje się spryskując płytkę pirydyną i umieszczając ją w świetle nadfioletowym o długości fali 366 nm. Używając światła o tym samym natężeniu prowadzi się również detekcję nitrofuranów występujących w mięsie wieprzowym i wołowym. Na chromatogramie pojawiają się wówczas żółte plamki na purpurowym tle. W wołowinie i wieprzowinie obecne są też chloramfenikole i sulfonamidy. Po odparowaniu nadmiaru pirydyny są one wywoływane za pomocą fluorescaminy. Na płytce można zaobserwować powstawanie żółtych plamek na fioletowym tle [6,7,23].
Hydrofilowe witaminy mogą być także wizualizowane metodami fizycznymi. Witaminę B2 (ryboflawinę) obserwuje się w świetle widzialnym jako żółtą zaś B12 (kobalaminę) jako różową plamkę. Gasząc fluorescencji w świetle UV o długości 254 nm można prowadzić detekcję:
- witaminy B1 – detekcja z wykorzystaniem tiaminy
- witaminy B3 – detekcja z wykorzystaniem niacyny
- witaminy B6 – detekcja z wykorzystaniem pirydoksyny
- witaminy B12 – detekcja z wykorzystaniem kobalaminy
- kwasu foliowego
Powyższe substancje uwidaczniają się przy tej długości fali jako ciemne plamy na chromatogramie. Jeśli długość światła UV zwiększy się do 366 nm to następuje wzbudzenie fluorescencji witamin B1, B2, B6 czego efektem są odpowiednio, niebieskie, żółte i ciemnoniebieskie plamki [6,7].
Metody radiometryczne
Do metod fizycznych oprócz fotometrii absorpcyjnej, fluorescencji i fosforescencji (metody optyczne) zalicza się też metody radiometryczne, stosowane w przypadku substancji znakowanych izotopami promieniotwórczymi. Koudelkova’ i współpracownicy [22] zastosowali tę metodę do oznaczania radiochemicznej produkcji radionuklidów. Przeprowadzane badania miały na celu kontrolowanie radiochemicznej czystości radiofarmaceutyków. W metodach radiometrycznych bardzo często wykorzystywano radionuklidy stosowane przede wszystkim jako wskaźniki w badaniach farmaceutycznych, biologicznych oraz w technologii genetycznej [22,27].
Metody biologiczno-fizjologiczne
Detekcja biologiczno–fizjologiczna polega na wykorzystaniu aktywności biologicznej specyficznych substancji, które mają być rozdzielane. Jeśli dana substancja jest nieaktywna chemicznie wówczas nie zachodzi interferencja. W takim przypadku wstępne oczyszczanie próbki można pominąć. Granice oznaczalności badanych związków identyfikowanych za pomocą wizualizacji biologiczno–fizjologicznej są często przybliżone do granic oznaczalności z zastosowaniem klasycznych metod. Za pomocą detekcji biologiczno–fizjologicznej można identyfikować antybiotyki, insektycydy, fungicydy, alkaloidy, mykotoksyny, witaminy oraz wiele innych związków.
Wykorzystywane w tej metodzie mikroorganizmy przeprowadzają poszczególne odczynniki w ich pochodne. Pochodne te mają intensywne zabarwienie, dzięki czemu można prowadzić ich detekcje na płytkach chromatograficznych. Jednak do analiz środowiskowych znacznie częściej używa się reakcji enzymatycznych służących do detekcji głównie pestycydów karbaminianowych i fosforoorganicznych [4,6,27].
Chromatografię TLC z zastosowaniem reakcji enzymatycznych Popiel i współpracownicy [27] zastosowali do wizualizacji związków fosforoorganicznych. Substratami reakcji enzymatycznej były estry 4-metyloumbelliferonu. Dzięki pomiarom fluorescencji produktu reakcji (4-metyloumbelliferonu) można było rejestrować przebieg omawianej reakcji na płytkach chromatograficznych. Metoda TLC z zastosowaniem reakcji enzymatycznych polegała na dociskaniu do płytki bibuły nasączonej odpowiednim roztworem. Na tej podstawie eliminowano ze środowiska reakcji rozpuszczalniki organiczne powodujące rozpuszczanie się estrów 4-metyloumbelliferonu. Za pomocą tego rodzaju detekcji oznaczono sarin, soman oraz tabun – silnie toksyczne substancje fosforoorganiczne, które używano jako gazy bojowe. Wykorzystywana metoda jest bardzo czuła w stosunku do tych związków [27].
Metody ciekłokrystaliczne
W ciekłokrystalicznej metodzie wizualizacji chromatogramów wykorzystuje się specjalną, porowatą, nieprzezroczystą folie nasyconą ciekłym kryształem. Jeśli umieści się ją w świetle spolaryzowanym wówczas przyjmuje ona jednolitą barwę na całej swojej powierzchni. Detekcja danej substancji z zastosowaniem omawianej metody polega na tym, że rozwiniętą płytkę chromatograficzną dociska się do nasyconej ciekłym kryształem folii. W taki sposób substancje znajdujące się na płytce w postaci plamek przechodzą do ciekłego kryształu, którego struktura przekształca się w ciecz izotropową. Na folii zaś w świetle spolaryzowanym można zaobserwować różniące się od tła kolorowe plamki identyfikowanych substancji, które są jednocześnie odbiciem chromatogramu znajdującego się na płytce. Metodę ciekłokrystaliczną można wykorzystywać do wszystkich rodzajów sorbentów [1,25,27,29].
Podsumowanie
Chromatografia cienkowarstwowa jest stosunkowo prosta metodą rozdzielania i oznaczania wielu, często skomplikowanych mieszanin substancji organicznych i biologicznych. Słabością tej techniki były metody wizualizacji i identyfikacji rozdzielanych substancji, ale dzięki opracowaniu wielu nowych metod wywoływania barwy rozdzielanych składników uległa poprawie zarówno czułość i selektywność metody jak i uprościła się identyfikacja rozdzielonych składników.
Literatura
1. Z. Witkiewicz, Podstawy chromatografii, WNT, Warszawa 2005
2. A. Berthillier, Chromatografia i jej zastosowanie, PWN, 1975
3. http://www.pg.gda.pl/chem/Dydaktyka/Analityczna/ProfKaminski/3/12.pdf
4. B. Borkowski, (Praca zbiorowa) Chromatografia cienkowarstwowa w analizie farmaceutycznej, Państwowy Zakład Wydawnictw Lekarskich, Warszawa 1973,
5. P.E. Wall, Thin-layer Chromatography A Modern Practical Approach, The Royal Society of Chemistry, Cambridge, 2005
6. T. Toyo’oka, Modern Derivatization Methods for Separation Sciences,1999
7. J. Błądek, M. Knap, J. Górski, Zastosowanie instrumentalnej chromatografii cienkowarstwowej do analiz środowiskowych. Cz. I. Idea i znaczenie metody, Problemy ekologii, (2003), nr 3 (7),102 – 109
8. A.Matuszewska, A. John, Some possibilities of thin layer chromatographic analysis of the molecular phase of Baltic amber and other natural resins, Acta Chromatographica, (2004), No. 14, 82 – 91
9. S. W. Husain, V. Ghoulipour, H. Sepahrian, Chromatographic behaviour of antibiotics on thin layers o fan inorganic ion-exchanger, Acta Chromatographica, (2004), 14, 102–109.
10. Z. Jun, T. Ninghua, Application of a new TLC chemical method for detection of cyclopeptides in plants, Chinese Science Bulletin, (2000), Vol.45, No.20,
1825 – 1831
11. D.A. Skoog, D.M. West,F.J. Holler, S.R.Crouch, Podstawy chemii analitycznej. Tom 2, Wydawnictwo Naukowe PWN, Warszawa 2007
12. A.Pyka, D. Gurak, K.Bober, A.Niestrój, Application of new agents for selected essential oil components in TLC, Chem. Anal., (2002), 47, 691 – 699
13. E. L. Ponder, B. Fried, J. Sherma, Thin layer chromatographic analysis of hydrophilic vitamins In standarts and from Helisom trivolvis snails, Acta Chromatographica, (2004), 14, 70–81.
14. W. Wardas, I. Lipska, J. Łebek, Alkacymetric agents application to phenols visualising in thin layer chromatography, Chem.Anal., (1998), 43, 99 – 106
15. J. Namie, (Praca zbiorowa) Fizykochemiczne metody kontroli zanieczyszczeń, WNT, Warszawa 1998
16. M. Litwin, S. Styka-Wlazło, J. Szymońska, Chemia organiczna. Cz. II. Nowa Era, Warszawa 2003
17. D. Kaźmierczak, W. Ciesielski, R. Zakrzewski, M. Żuber, Application of iodine-azide reaction for detection amino acids in thin – layer chromatography, J. Chromatogr. A, (2004), 1059, 171 – 174.
18. http://www.chemia.uni.lodz.pl/zai/podstrony/pol/badania.htm
20. A.Kotyński, Z.H. Kudzin, W. Ciesielski, J. Drabowicz, Unusual induction in the iodine – azide induced reaction exhibited by organophosphorus compounds on thin – layer chromatography plates, Journal of Chromatography A (1999) 831, 321-324.
21. A.Kotyński, Z.H. Kudzin, A. Okruszek, D. Krajewska, M. Olesiak, A. Sierzchała, Iodine – azide reagent in detection of thiophosphoryl nucleotides in thin – layer chromatography systems, Journal of Chromatography A (1997), 773, 285 -290
22. M. Koudelková, H. Vinšová, V. Jedináková – Křižová, Characterisation of Ho-DTPA and Y-DTPA complexes by capillaryisotachophoresis and TLC with radiometric detection, Czechoslovak Journal of Physics,(2003), Vol. 53, Suppl. A. A 769 – A 775
23. J. Sherma, Thin-layer chromatography in food and agricultural analysis, J. Chromatogr. A., (2000), 880, 129–147 .
24. F. Poole, Planar chromatography at the turn of the century, J. Chromatography A., (1999), 856, 399–427
25. J. Błądek, A. Papliński, S. Neffe, A. Rostkowski, Application of TLC for Detrmination of High Explosive Residues in Water and Soil Samples, Chem. Anal., (1998), 43, 711–717
26. R. Zakrzewski, W. Ciesielski, Detection of mercaptopyridines and mercaptopyrimidines in planarchromatography with iodine–azide reaction as a detection system, Journal of Chromatography B,(2005), 824, 222 – 228
27. S. Popiel, Z. Witkiewicz, A. Kapała, M. Kwaśny, Thin-layer chromatography and enzymatic analysis of phosphororganic compounds Rusing 4-methylumbelliferone esters, Chem. Anal. (1998), 43, 733 – 741
28. A.W. Kiselev, Discussions Faraday Soc., (1965), 40, 205
29. B.Halliwell, How to characterize a biological antioxidant, Free Rad. Res. Commun., (1990), 9, 1-32
*Andrzej GIERAK, Agata SKORUPA, Iwona ŁAZARSKA – Uniwersytet Jana Kochanowskiego, Instytut Chemii, Zakład Chemii Analitycznej, Kielce

