Wybór materiału do badań
Analizy hormonów steroidowych są prowadzone przy wykorzystaniu zróżnicowanego materiału biologicznego. Oznaczenia prowadzi się m. in. w kale, ekstraktach z tkanek, płynie owodniowym, włosach oraz płynach ustrojowych (krew, surowica i osocze, ślina oraz mocz) (Tab. 1) [2]. W związku z faktem, iż pierwsza grupa próbek nie jest preferowana ze względu na konieczność skomplikowanej, pracochłonnej oraz czasochłonnej obróbki materiału, najczęściej stosowane są płyny ustrojowe [3].
Procedura poboru próbek krwi może być przyczyną wzrostu poziomu niektórych kortykosteroidów, wydzielanych w ramach odpowiedzi organizmu na stres [10]. Co więcej, analiza hormonów steroidowych we krwi może być zaburzona w związku z pulsacyjnym wydzielaniem niektórych związków w rytmie dobowym oraz miesięcznym. Ślina również charakteryzuje się mało inwazyjnym sposobem pobierania próbki, jednakże stężenie steroidów w tej matrycy jest około 1000-5000 niższe niż we krwi [11]. Badanie śliny jest bardzo wartościowe ze względu na to, iż to umożliwia ocenę wolnej frakcji hormonów, które będąc niezwiązane z białkami, wykazują aktywność biologiczną. Wybór moczu do analizy hormonów steroidowych jest uzasadniony w określonych przypadkach klinicznych i ma specyficzne zastosowanie. Pobieranie próbek moczu jest nieinwazyjne oraz niestresogenne w porównaniu do osocza i plazmy, a stężenie wyżej wspomnianych związków jest wyższe niż w przypadku śliny. W związku z faktem, iż z moczem wydalane są metabolity większości hormonów steroidowych produkowanych przez organizm, możliwe jest badanie we wspomnianej matrycy pełnych profili hormonalnych.
Metody stosowane do oznaczania hormonów steroidowych
Metody immunochemiczne
Metody immunochemiczne są stosowane w diagnostyce klinicznej najczęściej w celu przeprowadzania szybkich i rutynowych oznaczeń poziomów hormonów steroidowych. Techniki te wykorzystują selektywne wiązanie cząsteczek hormonów do przeciwciał [3].
Techniki te bazują na jednej ogólnej zasadzie. Metody te opierają się na wykorzystaniu przeciwciał oraz czynnika mierzalnego: w przypadku metody RIA (ang. Radioimmunoassay) jest to radioizotop, w analizie immunofluorescencyjnej (ang. Fluoroimmunoassay) są to izotopy metali ziem rzadkich, enzymy katalizujące reakcje barwne w metodzie ELISA (ang. Enzyme-Linked ImmunoSorbent Assay) oraz cząsteczki świecące podczas rozpadu (chemiluminescencja) lub wywołujące reakcję elektrochemiluminescencyjną.
W metodzie RIA wykorzystywane są znakowane izotopowo przeciwciała. Zachodząca reakcja wiązania hormonu steroidowego z przeciwciałem umożliwia w oparciu o pomiar radioaktywności izotopu promieniotwórczego, ilościową analizę znajdującego się w roztworze hormonu [12]. Do znakowania używa się m.in. izotopu 125I, 14C, 3H. Jeden ze składników reakcji jest związany z fazą stałą, natomiast drugi składnik znajduje się w fazie płynnej. Inna możliwość to obecność obu składników w fazie płynnej. Wyznakowane przeciwciała lub antygen są inkubowane z badaną surowicą, w której znajduje się badany analit, a następnie przeprowadzana jest reakcja z przeciwciałami przeciwko niemu. Na etapie końcowym wykonywany jest pomiar radioaktywności danego kompleksu. Dostępne procedury oznaczeń klinicznych metodą RIA umożliwiają analizy pojedynczych hormonów lub grup metabolitów zawierających charakterystyczną grupę funkcyjną tj. np. 17-ketosteroidów obecnych we krwi lub moczu.
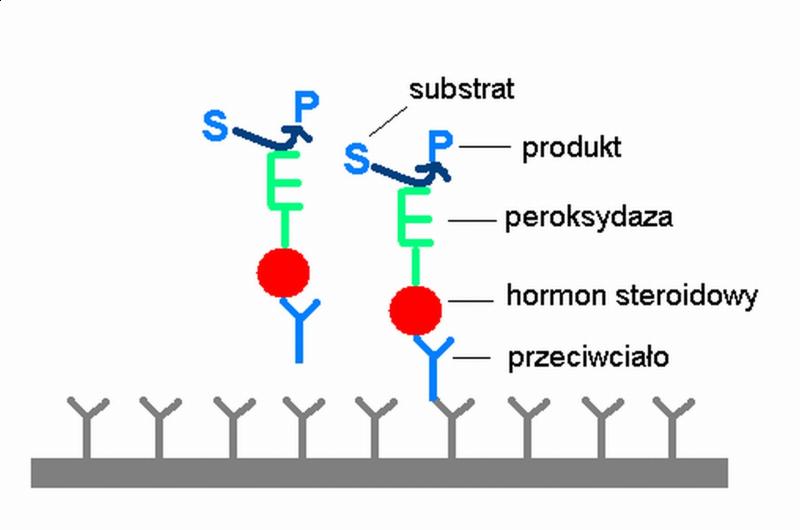
ELISA wykorzystuje przeciwciała poliklonalne lub monoklonalne, które są skoniugowane z odpowiednim enzymem [13]. Antygen zostaje związany z podłożem, a po dodaniu przeciwciał tworzone są kompleksy immunologiczne (Rys.1). Kolejno, do roztworu dodawany jest substrat dla enzymu związanego z przeciwciałem. Zachodzącym reakcjom enzymatycznym towarzyszą określone barwne reakcje, które umożliwiają wykrycie hormonów steroidowych dzięki obecności barwnych produktów, powstających z bezbarwnych substratów.
Rys. 1. Schemat oznaczania hormonów steroidowych za pomocą techniki ELISA
Obecnie ze względu na radioaktywność izotopów odstępuje się od oznaczeń metodą RIA. Metoda EIA (ELISA) również nie jest optymalna w przypadku analiz, gdzie wymagana jest wysoka precyzja oznaczeń. Związane to jest z faktem, iż standaryzacja wspomnianej techniki jest trudna do przeprowadzenia, a pomiary są zależne od aktywności enzymu, czasu trwania reakcji oraz temperatury. W związku ze wspomnianą wadą RIA, najpowszechniej stosowanymi obecnie metodami immunochemicznymi są metody chemiluminescencyjne oraz elektrochemiluminescencyjne.
Techniki immunochemiczne obarczone są dodatkowymi ograniczeniami, z których najważniejsze to brak możliwości analizy w jednej próbie pełnego profilu hormonalnego. Co więcej, badania dowodzą, iż inną wadą oznaczeń immunochemicznych jest możliwość zajścia reakcji krzyżowych (ang. cross-reaction) pomiędzy steroidami bądź też innymi związkami wiążącymi się do tego samego przeciwciała [14]. Proces ten jest spowodowany strukturalnym podobieństwem pomiędzy wieloma steroidami i substancjami interferującymi oraz zanieczyszczeniami znajdującymi się w płynach biologicznych. Badania dowodzą, że otrzymane wyniki mogą być obarczone błędem wynoszącym 30-100%. Problem błędnych pomiarów dotyczy w szczególności moczu, a w mniejszym stopniu próbek krwi. Reakcje krzyżowe można wyeliminować poddając próbki wstępnej obróbce za pomocą ekstrakcji do fazy stałej (ang. Solid Phase Extraction, SPE) lub rozdziałom chromatograficznym przy wykorzystaniu wysokosprawnej chromatografii cieczowej (ang. High Performance Liquid Chromatography, HPLC) [15]. Inną wadą opisywanych wyżej metod jest konieczność inwazyjnego pobrania stosunkowo dużych ilości próbki, co w przypadku krwi, stanowi stresogenne doświadczenie dla pacjenta. Stres jest odpowiedzialny za podniesienie poziomu wydzielanych do krwi glikokortykoidów, co może zaburzać wyniki analiz hormonalnych [16].
Podsumowując, metody immunochemiczne są dobrym narzędziem do szybkich oznaczeń, nie wymagających dużej precyzji oraz selektywności.
Techniki chromatograficzne
Techniki chromatograficzne charakteryzują się dużą niezawodnością, wysoką selektywnością oraz czułością. Nie są one obarczone problemem reakcji krzyżowych tak jak analizy immunochemiczne. Profilowanie hormonalne wymaga wysokiej specyficzności, a co za tym idzie wykorzystania technik chromatograficznych [17]. Rozdział związków zależny jest od takich parametrów jak powinowactwo do fazy stałej, masa cząsteczkowa, lotność lub polarność związków. Najbardziej powszechne metody stosowane do badań steroidów stanowią chromatografia gazowa (ang. Gas Chromatography, GC) oraz chromatografia cieczowa [18].
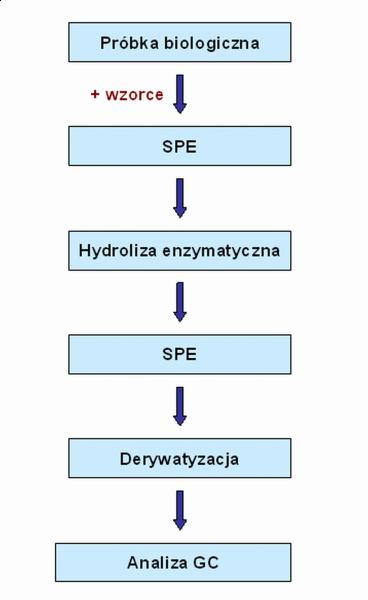
Jak wcześnie wspomniano, próbki moczu są preferowane jako matryce do badań ze względu na nieinwazyjny charakter poboru próbki oraz fakt, iż dają one pełny obraz profilu hormonalnego. Natomiast płyny ustrojowe stanowią złożone matryce i wymagają wielu etapów przygotowań, które bazują zazwyczaj na procedurze Shackletona, bądź jej modyfikacjach. Kolejne etapy przygotowania próbki to: oczyszczanie przy użyciu SPE, hydroliza koniugatów, ekstrakcja wolnych steroidów oraz ich derywatyzacja (Rys.2) [19].
Rys. 2. Przygotowanie próbki biologicznej do analizy za pomocą chromatografii gazowej
Technika chromatografii gazowej opiera się na rozdziale cząsteczek wykorzystując ich lotność oraz ich powinowactwo do fazy stacjonarnej. Cecha ta jest zależna od masy cząsteczkowej i wewnątrzcząsteczkowych interakcji. Biorąc pod uwagę fakt, iż steroidy są dużymi cząsteczkami o temperaturze topnienia ponad 300 °C, zawierają grupy ketonowe i hydroksylowe, a niektóre związki są termolabilne, hormony przeprowadza się w odpowiednie pochodne [20]. Taki zabieg zwiększa termostabilność, lotność i poprawia symetryczność pików. Najczęściej wykorzystywane reakcje to sililowanie i acylowanie. Do sililowania najczęściej używane są pochodne trimetylosilanu (TMS), a wśród nich należy wymienić: N,O-bis-(trimetylosililo)trifluoroacetamid (BSTFA), N-metylo-N-(trimetylosililo)trifluoroacetamid (MSTFA), trimetylosililoimidazol (TMSIM) [21] oraz trimetylochlorosilan (TMCS). Derywatyzację najczęściej przeprowadza się w fazie ciekłej lub jako adsorpcję analitu na specjalnym włóknie (ang. Solid Phase Microextraction, SPME) [22]. Zwiększenie termostabilności oraz lotności analitów możliwe jest także dzięki przeprowadzeniu hydrolizy koniugatów. Dowiedziono, że w wysokich temperaturach glukuronidy są degradowane, a zastosowanie hydrolizy zapobiega temu procesowi. Detektorami stosowanymi najczęściej w analizach hormonów steroidowych są: detektor płomieniowo-jonizacyjny (ang. Flame Ionization Detector, FID) oraz spektrometr masowy (MS) [23].
Hormony steroidowe analizowane techniką HPLC zazwyczaj nie wymagają derywatyzacji. Biorąc jednak pod uwagę fakt, iż steroidy różnią się rodzajem i liczbą chromoforów, wybór detektora, który umożliwiałby równoczesną analizę wszystkich metabolitów w moczu, jest obarczony trudnościami [24]. Najczęściej wykorzystywane detektory to detektor z matrycą fotodiodową (ang. Photo Diode Array, PDA) oraz detektory masowe (MS). Wśród tych ostatnich należy wymienić detektory z pojedynczym i potrójnym kwadrupolem oraz detektory czasu przelotu (ang. Time-of-Flight, TOF). Jako technikę jonizacji najczęściej stosuje się elektrorozpylanie (ang. Electrospray Ionization, ESI) [25], jonizację chemiczną pod ciśnieniem atmosferycznym (ang. Atmospheric Pressure Chemical Ionization, APCI) oraz fotorozpylanie pod ciśnieniem atmosferycznym (ang. Atmospheric Pressure Photoionization, APPI) [26]. Wśród zalet techniki LC-MS należy wymienić brak konieczności derywatyzacji, mniej czasochłonne przygotowanie próbki oraz możliwość badania koniugatów bez przeprowadzania ich hydrolizy. Warto również wspomnieć, że coraz częściej pojawiają się doniesienia o wykorzystaniu ultrasprawnej chromatografii cieczowej (ang. Ultra Performance Liquid Chromatography, UPLC) w połączeniu ze spektrometrem masowym do oznaczania poziomu hormonów steroidowych [27].
Podsumowanie
W badaniach klinicznych, ze względu na możliwość prowadzenia szybkich i rutynowych analiz, najczęściej stosowanymi metodami badania wspomnianych związków są techniki immunochemiczne (RIA, ELISA). Wspomniane metody są jednak obarczone błędem wynikającym z reakcji krzyżowych. Analiza hormonów steroidowych przy użyciu technik chromatograficznych, pomimo wymogu czasowego, sprzętowego oraz bardziej skomplikowanej obróbki materiału biologicznego niż w przypadku metod immunochemicznych, jest bardziej informatywna i umożliwia wyznaczenie pełnego profilu hormonalnego. Jest ona polecana szczególnie w przypadku diagnozowania defektów lub niedoborów enzymatycznych, zaburzeń metabolizmu oraz wrodzonych chorób o naturze endokrynologicznej.
Tab. 1 Przykłady oznaczania hormonów steroidowych w różnym materiale biologicznym
|
Materiał badawczy
|
Oznaczane hormony steroidowe
|
Metoda oznaczeń
|
Literatura
|
|
Mocz
|
Androgeny, estrogeny, kortykosteroidy
|
GC-MS/MS
|
[4]
|
|
Surowica
|
kortykosteroidy
|
HPLC-RIA
|
[5]
|
|
Plazma
|
Androgeny anaboliczne
|
GC-MS/MS
|
[6]
|
|
Włosy
|
Anaboliczne steroidy
|
GC-MS/MS
|
[7]
|
|
Tkanka tłuszczowa
|
Androgeny
|
GC-MS/MS
|
[8]
|
|
Kał
|
Ketosteroidy
|
GC, GC-MS
|
[9]
|
Literatura
1. Kołodziejczyk A.: Naturalne związki organiczne, Wydawnictwo Naukowe PWN; 2004.
2. Kotłowska A., Kamysz W.: Oznaczanie hormonów steroidowych w moczu. Bromatologia i Chemia Toksykologiczna, 1, 1-8; 2010.
3. Andrew R.: Clinical measurement of steroid metabolism. Best Practice & Research Clinical Endocrinology & Metabolism, 15: 1-16; 2001.
4. Remer T., Boye K. R., Hartmann M. F., Neu C., Schoenau E., Manz F., Wudy S. A.: Adrenal Steroid Hormones and Metaphyseal Bone in Children. Hormone Research, 62, 221-226; 2004.
5. Schöneshöfer M., Jaster H.J., Fenner A.: HPLC-RIA: A Convenient Alternative for the Specific Estimation of Multiple Steroid Hormones. Fresenius’ Journal of Analytical Chemistry, 301,130-131; 1980.
6. Peng S-H, Segura J., Farré M., González J. C., de la Torre X.: Plasma and urinary markers of oral testosterone undecanoate misuse. Steroids, 67, 39-50; 2002.
7. Gambelunghe C., Sommavilla M., Ferranti C., Rossi R., Aroni K., Manes N., Bacci M.: Analysis of anabolic steroids in hair by GC/MS/MS. Biomedical Chromatography, 21, 369 –375; 2007.
8. Lamounier-Zepter V., Ehrhart-Bornstein M.: Fat tissue metabolism and adrenal steroid secretion. Current Hypertension Reports, 8, 30-34; 2006.
9. Devaux P. G., Horning M. G., Hill R. M., Horning E. C.: O-benzyloximes: Derivatives for the study of ketosteroids by gas chromatography. Application to urinary steroids of the newborn human. Analytical Biochemistry, 41, 70-82; 1971.
10. Corbett B. A., Mendoza S., Abdullah M., Wegelin J. A., Levine S.: Cortisol circadian rhythms and response to stress in children with autism. Psychoneuroendocrinology, 31, 59–68; 2006.
11. Mansfield R. K., Bhattacharyya D., Hartman N. G., Jay M.: Scintillation proximity radioimmunoassay with microporous membranes. Applied Radiation and Isotopes, 47, 323-328; 1996.
12. Hsing A. W., Stanczyk F. Z., Bẻlanger A., Schroeder P., Chang L., Falk R. T., Fears T. R.: Reproducibility of Serum Sex Steroid Assays in Men by RIA and Mass Spectrometry. Cancer Epidemiology. Biomarkers & Prevention, 16, 1004-1008; 2007.
13. Ebrahimi M.: A Rapid ELISA Method for 17, 20β-dihydroxy-4-pregenen-3-one (17,20βP) Hormone Using Acetylcholinesterase Enzyme as Tracer. Journal of Medical Science Research, 3, 103-110; 2004.
14. Chandan K. J., Esahak A. Antibody binding characteristics of geometrical isomers of testosterone 3-(O-carboxymethyl)oxime. Steroids, 64, 228-232; 1999.
15. Lee C., Goeger D. E. Interference of 6β-Hydroxycortisol in the Quantitation of Urinary Free Cortisol by Immunoassay and Its Elimination by Solid Phase Extraction. Clinical Biochemistry, 31, 229-233; 1998.
16. Hamrahian A. H., Oseni T. S., Arafah B. M. Measurements of serum free cortisol in critically ill patients. New England Journal of Medicine, 350, 1629-1638; 2004.
17.Wolthers B. G., Kraan G. P.. Clinical applications of gas chromatography and gas chromatography-mass spectrometry of steroids. Journal of Chromatography A, 843, 247-274; 1999.
18. Takeda M., Maeda M., Tsuji A. Chemiluminescence high performance liquid chromatography of corticosteroids using lucigenin as post-column reagent. Biomedical Chromatography, 4, 119–122; 1990.
19. Kotłowska A., Maliński E., Sworczak K., Kumirska J., Stepnowski P. The urinary steroid profile in patients diagnosed with adrenal incidentaloma. Clinical Biochemistry, 42, 448-454; 2009.
20. Thienpont L. M., De Brabandere V. I., Stöckl D., De Leenheer A. P. Candidate Reference Method for Determining Serum Cortisol Based on Isotope Dilution–Gas Chromatography/Mass Spectrometry Using Heptafluorobutyrilation as Derivatization Method. Analytical Biochemistry, 234, 204-209; 1996.
21. Zhou Y-G., Wang Z-J., Jia N. Formation of multiple trimethylsilyl derivatives in the derivatization of 17α-ethinylestradiol with BSTFA or MSTFA followed by gas chromatography-mass spectrometry determination
Journal of Environmental Sciences, 19, 879-884; 2007.
22. Yang L., Luan T., Lan C. Solid-phase microextraction with on-fiber silylation for simultaneous determinations of endocrine disrupting chemicals and steroid hormones by gas chromatography–mass spectrometry. Journal of Chromatography A, 1104, 23-32; 2006.
23. Hartmann S., Steinhart H. Simultaneous determination of anabolic and catabolic steroid hormones in meat by gas chromatography–mass spectrometry. Journal of Chromatography B: Biomedical Sciences and Applications, 704, 105-117; 1997.
24. Al Sharef O., Feely J., Kavanagh P. V.,Scott K. R., Sharma S. C. An HPLC method for the determination of the free cortisol/cortisone ratio in human urine. Biomedical Chromatography, 21, 1201-1206; 2007.
25. Yang Y., Shao B., Zhang J., Wu Y., Duan H. Determination of the residues of 50 anabolic hormones in muscle, milk and liver by very-high-pressure liquid chromatography–electrospray ionization tandem mass spectrometry. Journal of Chromatography B, 877, 489-496; 2009.
26. Guo T., Taylor R. L., Singh R. J., Soldin S. J. Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry. Clinica Chimica Acta, 372, 76-82; 2007.
27. Van der Heeft E., Bolck Y.J.C., Beumer B., Nijrolder A.W.J.M., Stolker A.A.M., Nielen M.W.F. Full-Scan Accurate Mass Selectivity of Ultra-Performance Liquid Chromatography Combined with Time-of-Flight and Orbitrap Mass Spectrometry in Hormone and Veterinary Drug Residue Analysis Journal of the American Society for Mass Spectrometry, 20, 451-463; 2009.
*Alicja Kotłowska1, Jarosław Szulfer2 , Wojciech Kamysz1 – 1 Wydział Farmaceutyczny, Gdański Uniwersytet Medyczny, 2Polpharma SA, Badania i Rozwój