Metody mikroskopowe w mikrobiologii
Damian Sztucki
Komórki prokariotyczne, których przedstawicielami są bakterie mają najczęściej do kilku mikrometrów średnicy. Ich rozmiary znajdują się poza możliwościami rozdzielczymi ludzkiego oka, czy nawet lupy. Z tego powodu do dokładnego przyglądania się ich budowie i zachowaniu stosuje się odpowiednie mikroskopy, których podstawowym zadaniem jest maksymalne powiększenie oglądanego obrazu. Przykładem mikroskopów są: optyczne, w których wykorzystuje się wiązkę światła do uzyskania obrazu preparatu, lub elektronowe, w których do tego celu służy wiązka elektronów.
Podstawy mikroskopii
Przełomu w dziedzinie mikroskopii dokonał uznany wynalazca i przedsiębiorca Antoni van Leeuwenhoek. Udoskonalił on zaproponowaną ponad wiek wcześniej przez holenderski duet ojca i syna Jenssen model mikroskopu. Po raz pierwsze dokonał obserwacji żywych komórek
pod dużym powiększeniem (erytrocyty, plemniki, pierwotniaki). Możliwość zaobserwowania tego, co gołym okiem jest niedostępne przyczyniła się do rozwoju wielu gałęzi biologii, w tym: cytologii i mikrobiologii.
We współczesnej wersji mikroskopy możemy spotkać w różnej postaci i o różnym przeznaczeniu. Łączy je wszystkie ich fundamentalna funkcja – powiększanie niedostępnego obrazu. Co wyróżnia jedne mikroskopy od drugich to ich jakość powiększania i zdolność rozdzielcza. Zarówno powiększenie jak i zdolność rozdzielcza są niezwykle ważne jeśli chcemy otrzymać obraz czegoś bardzo małego. Na przykład, jeżeli mikroskop ma duże powiększenie, ale słabą rozdzielczość to wszystko co w obrazie to większa wersja rozmazanego obiektu. Różne typy mikroskopów różnią się powiększeniem i zdolnością rozdzielczą.
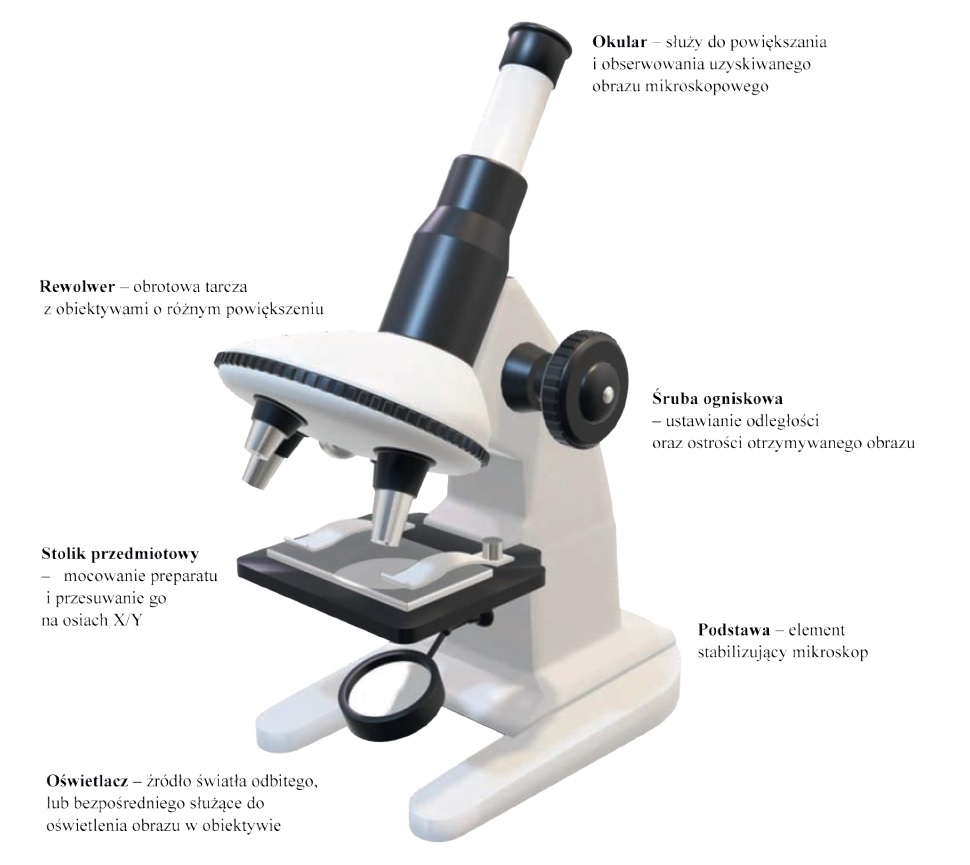
Schemat 1. Uproszczony schemat mikroskopu optycznego z wyróżnionymi ważniejszymi elementami
W konstrukcji mikroskopu są połączone dwa układy: optyczny i mechaniczny. Układ optyczny składa się z dwóch splecionych ze sobą części oświetleniowej i powiększającej. Jeden służy do optymalnego oświetlenie obserwowanego obiektu. Drugi do dwustopniowego powiększenia
jego obrazu. Układ mechaniczny ma zapewniać właściwe położenie poszczególnych elementów układu optycznego. W konstrukcji mikroskopu kluczowa jest stabilność i precyzja układu mechanicznego oraz wzajemna równoległość i współśrodkowość składowych układu
optycznego. W lepszych mikroskopach badawczych znajdują się wszelkie regulacje temu służące oraz możliwość rozbudowy o elementy realizujące różne sposoby oświetlenia, obserwacji, rejestracji obrazu. W uproszczonych mikroskopach lub przeznaczonych do rutynowych badań laboratoryjnych, rezygnuje się z niektórych elementów celem uzyskania tańszych w produkcji rozwiązań. Sztandarowym elementem
wyposażenia laboratorium mikrobiologicznego jest mikroskop, najczęściej optyczny. Dzięki nim można poznać kształty mikroorganizmów,
tworzone przez nie charakterystyczne układy komórek, ich liczebność w danym środowisku, a także pewnie elementy strukturalne. Mikroskop świetlny składa się z wielu elementów, których większość może być regulowana i przesuwana wzdłuż osi optycznej, jak i na boki [Schemat 1]. Powszechnie przyjętym systemem regulacji, założonym już na etapie konstrukcji urządzenia jest system Koehlera. Zgodnie z nim, należy zwrócić uwagę na przysłony irysowe układu świetlnego. Jedna z nich umieszczona jest pod kondensorem i nazywana jest przysłoną aperturową. Zmieniając średnicę jej otworu, zmienia się kąt rozwarcia stożka światła wychodzącego z kondensora, czyli zmienia
się apertura. Druga przysłona, znajdująca się wewnątrz podstawy mikroskopu, nazywa się przysłoną pola. Jej nazwa wynika bezpośrednio
z pełnionej przez nią funkcji. Obraz przysłony pola tworzy się bowiem w tej samej płaszczyźnie, w której powstaje obraz preparatu, a więc brzegi jej otworu są widoczne na tle pola widzenia.
Mikroskopy świetlne
Zwykły mikroskop świetlny używany w laboratorium nazywa się mikroskopem złożonym, ponieważ zawiera dwa rodzaje soczewek, które służą do powiększania obiektu. Soczewka znajdująca się najbliżej oka nazywana jest okiem, natomiast soczewka znajdująca się najbliżej obiektu nazywana jest obiektywem. Większość mikroskopów ma na swojej podstawie aparat zwany kondensatorem, który kondensuje promienie świetlne w silną wiązkę. Przesłona umieszczona na kondensorze kontroluje ilość przechodzącego przez nią światła. Aby powiększyć obiekt, światło jest wyrzucane przez otwór w scenie, gdzie uderza w obiekt, a następnie wpada do obiektywu. Tworzony jest
obraz, który staje się obiektem dla soczewki oka, która ponownie powiększa obraz. Zatem całkowite powiększenie możliwe przy użyciu mikroskopu to powiększenie uzyskane przez obiektyw pomnożone przez powiększenie uzyskane przez soczewkę okularową.
Złożony mikroskop świetlny często zawiera cztery soczewki obiektywowe: soczewkę skanującą (4X), soczewkę małej mocy (10X), soczewkę
dużej mocy (40X) i soczewkę olejowo-immersyjną (100X). Z soczewką okularową, która powiększa 10-krotnie, całkowite możliwe powiększenia wyniosą 40-krotność z soczewką skanującą, 100-krotność z soczewką o małym powiększeniu, 400-krotność z soczewką o dużej powiększeniu i 1000-krotność z soczewką olejowo-immersyjną. Większość mikroskopów jest parafokalna. Termin ten oznacza, że mikroskop pozostaje w centrum uwagi, gdy przełączamy się z jednego obiektywu na drugi.
Zdolność do wyraźnego widzenia dwóch przedmiotów jako oddzielnych obiektów pod mikroskopem nazywana jest rozdzielczością mikroskopu. Rozdzielczość zależy częściowo od długości fali światła używanego do obserwacji. Światło widzialne ma długość fali około 550 nm, podczas gdy światło ultrafioletowe ma długość fali około 400 nm lub mniej. Rozdzielczość mikroskopu wzrasta wraz ze spadkiem
długości fali, więc światło ultrafioletowe pozwala wykryć obiekty niewidoczne w świetle widzialnym. Rozdzielczość soczewki odnosi
się do rozmiaru najmniejszego obiektu, który można zobaczyć za pomocą tej soczewki. Rozdzielczość zależy od długości fali użytego światła
i apertury numerycznej obiektywu. Apertura numeryczna (NA) odnosi się do najszerszego stożka światła, który może dostać się do obiektywu; NA jest wygrawerowany z boku soczewki obiektywu.
Aby zwiększyć rozdzielczość w przypadku obiektywu immersyjnego, kroplę olejku immersyjnego należy umieścić między soczewką a szkiełkiem. Olejek immersyjny ma taką samą zdolność do zaginania światła (wskaźnik załamania światła) jak szkiełko, więc utrzymuje światło w linii prostej, gdy przechodzi przez szkiełko do olejku i dalej do szkła obiektywu. obiektyw. Wraz ze wzrostem ilości światła wpadającego do obiektywu wzrasta rozdzielczość obiektu i można obserwować obiekty tak małe jak bakterie. Rozdzielczość jest ważna również w innych rodzajach mikroskopii.
Oprócz znanego mikroskopu złożonego mikrobiolodzy używają innych rodzajów mikroskopów, które umożliwiają oglądanie obiektów niewidocznych w mikroskopie świetlnym. Alternatywnym mikroskopem jest mikroskop ciemnego pola, który służy do obserwacji żywych krętków, na przykład wywołujących kiłę. Ten mikroskop zawiera specjalny kondensor, który rozprasza światło i powoduje, że odbija się ono od próbki pod kątem. Jasny obiekt jest widoczny na ciemnym tle. Drugim alternatywnym mikroskopem jest mikroskop z kontrastem fazowym. Ten mikroskop zawiera również specjalne kondensatory, które wyrzucają światło „przesunięte w fazie” i powodują jego przechodzenie przez obiekt z różnymi prędkościami. Pod tym mikroskopem wyraźnie widać żywe, niezabarwione organizmy, a za pomocą tego instrumentu można zobaczyć wewnętrzne części komórek, takie jak mitochondria, lizosomy i aparat Golgiego. Mikroskop fluorescencyjny wykorzystuje światło ultrafioletowe jako źródło światła. Kiedy światło ultrafioletowe uderza w przedmiot, wzbudza
jego elektrony i emituje światło w różnych odcieniach koloru. Ponieważ używane jest światło ultrafioletowe, rozdzielczość obiektu wzrasta. Ta technika laboratoryjna wykorzystuje barwniki fluorescencyjne i przeciwciała do identyfikacji nieznanych bakterii.
Mikroskopia elektronowa
Mikroskopia elektronowa to technika wykorzystująca wiązkę przyspieszonych elektronów do oświetlania i tworzenia obrazów próbek. Używając mikroskopii elektronowej, można osiągnąć znacznie większe poziomy powiększenia i rozdzielczość niż w mikroskopie świetlnym, ponieważ długość fali elektronów jest znacznie krótsza niż fotonów. Za pomocą tego instrumentu można zobaczyć wirusy i niektóre duże molekuły. Elektrony przemieszczają się w próżni, aby uniknąć kontaktu z odchylającymi się cząsteczkami powietrza, a magnesy skupiają
wiązkę na oglądanym obiekcie. Obraz jest tworzony na monitorze i oglądany przez technologa. W 1931 roku niemieccy naukowcy Max Knoll
i Ernst Ruska opracowali pierwszy model mikroskopu elektronowego. Ruska podążył za tym, dwa lata później, tworząc kolejny prototyp,
który mógł zapewnić większą rozdzielczość niż mikroskop świetlny, za co pięćdziesiąt lat później otrzymał nagrodę Nobla.
Bardziej tradycyjną formą mikroskopu elektronowego jest transmisyjny mikroskop elektronowy (TEM). Aby użyć tego instrumentu, umieszcza się ultra-cienkie plasterki drobnoustrojów lub wirusów na drucianej siatce, a następnie barwi je złotem lub palladem przed oglądaniem. Gęsto pokryte części próbki odchylają wiązkę elektronów, a na obrazie pojawiają się zarówno ciemne, jak i jasne obszary.
Skaningowy mikroskop elektronowy (SEM) jest bardziej współczesną formą mikroskopu elektronowego. Chociaż ten mikroskop daje mniejsze powiększenia niż TEM, SEM pozwala na trójwymiarowe widoki mikroorganizmów i innych obiektów. Stosuje się całe przedmioty, stosuje się barwienie złotem lub palladem.
Mikroskopia elektronowa ma wiele różnorodnych zastosowań w nauce i technologii. Wykorzystywano go do badania patogenów, takich
jak wirusy i bakterie, i jest szczególnie cenny w badaniu pojawiających się chorób wykorzystywanych w bioterroryzmie. Mikroskopia elektronowa ma również zastosowanie w przemyśle elektronicznym, gdzie jest wykorzystywana do kontrolowania procesów produkcyjnych w różnych zastosowaniach przemysłowych, w tym w lotnictwie, produkcji pojazdów silnikowych i przemyśle odzieżowym. Ponadto w kryminalistyce technika ta jest wykorzystywana na przykład do analizy włókien odzieży oraz pozostałości krwi i postrzału.
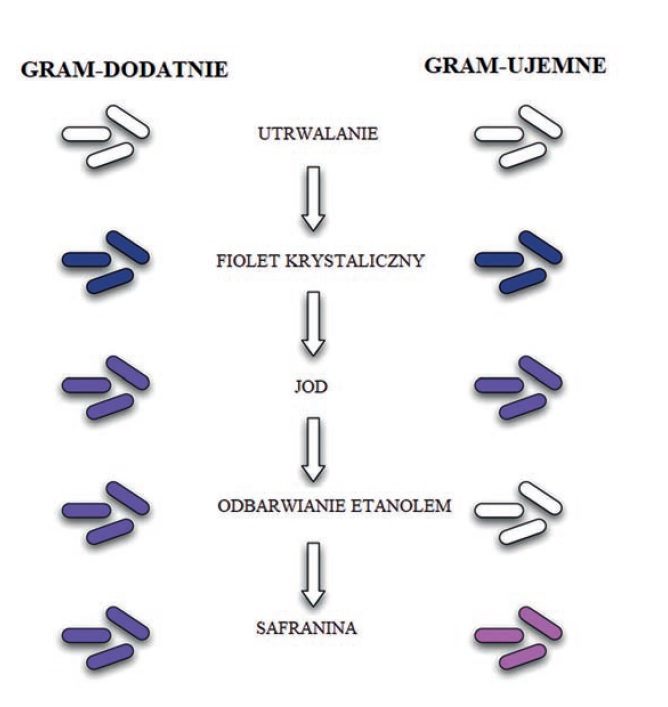
Schemat 2. Uproszczony schemat barwienia złożonego bakterii metodą Grama
Metody barwienia preparatów mikroskopowych Ze względu na fakt, iż cytoplazma drobnoustrojów jest zwykle przezroczysta, konieczne
jest wybarwienie mikroorganizmów, zanim będzie można je obejrzeć pod mikroskopem świetlnym. W niektórych przypadkach barwienie
nie jest konieczne, na przykład gdy drobnoustroje są bardzo duże lub gdy ma być badana ruchliwość, a kroplę drobnoustrojów można umieścić bezpośrednio na szkiełku podstawowym i obserwować w powiększeniu. Mokrą oprawę można również przygotować
umieszczając kroplę kultury na szkiełku nakrywkowym, a następnie odwracając ją na wydrążonym szkiełku. Ta procedura nazywana jest
wiszącą kroplą.
Co do zasady, barwienia dzieli się na proste i złożone. Kategoryzacja ta polega na wyróżnieniu jednego użytego w tym celu barwnika, bądź
kilku różnych. Barwienie proste można przeprowadzić za pomocą barwników zasadowych, takich jak fiolet krystaliczny i błękit metylenowy,
barwników naładowanych dodatnio, które są przyciągane do ujemnie naładowanych materiałów cytoplazmy drobnoustrojów. Alternatywą
jest użycie barwnika takiego jak nigrozyna lub czerwień Kongo, kwaśnych, ujemnie naładowanych barwników. Są odpychane przez ujemnie naładowaną cytoplazmę i gromadzą się wokół komórek, pozostawiając komórki czyste i niezabarwione. Ta technika nazywana jest techniką barwienia negatywowego.
Technika barwienia złożonego pozwala na rozróżnienie dwóch rodzajów organizmów. Barwienie metodą Grama to powszechna, ważna i najczęściej stosowana technika barwienia różnicowego w mikrobiologii, wprowadzona przez duńskiego bakteriologa Hansa Christiana
Grama w 1884 roku. Test ten różnicuje bakterie na bakterie Gram-dodatnie i Gram-ujemne, co pomaga w klasyfikacji i różnicowaniu mikroorganizmy [Schemat 1].
Podczas wykonywania barwienia metodą Grama najpierw nakładany jest fiolet krystaliczny, a następnie zaprawiony jod, który utrwala
barwnik wewnątrz komórki. Ściany komórkowe bakterii Gram-dodatnich mają grubą warstwę kompleksów białkowo-cukrowych zwanych peptydoglikanami, a zawartość lipidów jest niska. Odbarwianie komórki powoduje odwodnienie i kurczenie się grubej ściany komórkowej, co zamyka pory w ścianie komórkowej i zapobiega wydostawaniu się barwnika z komórki. Tak więc etanol nie może usunąć kompleksu fiolet krystaliczny – jod, który jest związany z grubą warstwą peptydoglikanu bakterii Gram-dodatnich i ma kolor niebieski lub fioletowy.
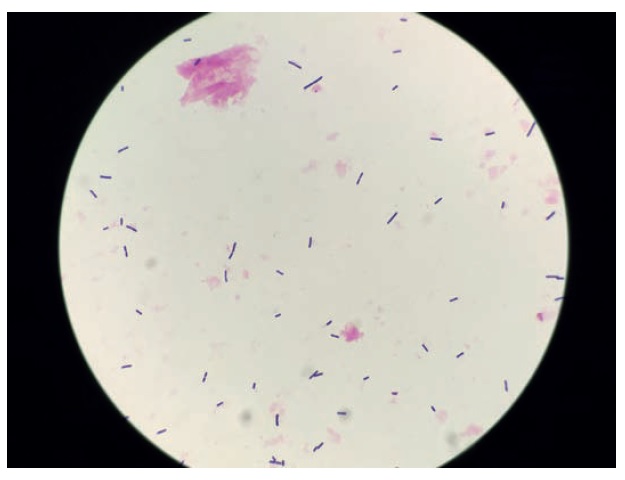
Fot. 1. Obraz mikroskopowy bakterii gram-dodatnich (barwienie Grama)
Z kolei ściana komórkowa bakterii Gram-ujemnych również przyjmuje kompleks fiolet krystaliczny – jod, ale dzięki cienkiej warstwie peptydoglikanu i grubej warstwie zewnętrznej, zbudowanej z lipidów, kompleks ten zostaje wypłukany. Gdy są wystawione na działanie etanolu, odbarwiacz rozpuszcza lipidy w ścianach komórkowych, co pozwala na wypłukanie kompleksu z komórek. Następnie, po ponownym zabarwieniu safraniną, przyjmują barwnik i wydają się czerwone.
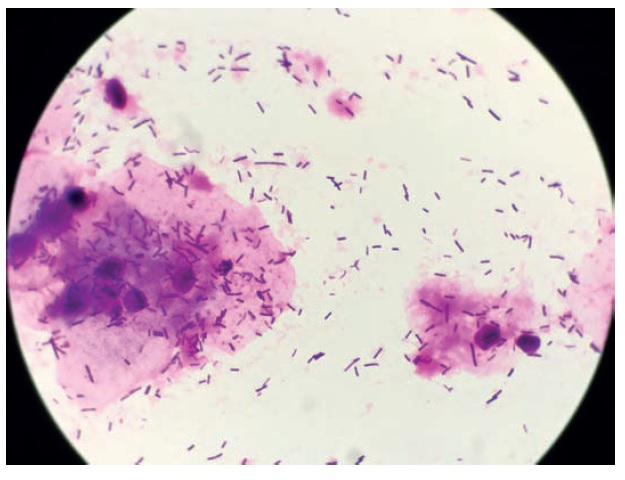
Fot. 2. Obraz mikroskopowy bakterii gram-ujemnych (barwienie Grama)
Inne techniki barwienia mają na celu identyfikację różnych ważnych struktur bakteryjnych. Na przykład specjalna technika barwienia uwydatnia wici bakterii poprzez powlekanie wici barwnikami lub metalami w celu zwiększenia ich szerokości. Do badania zarodników bakterii stosuje się specjalną technikę barwienia Schaeffer-Fultona. Zieleń malachitowa jest używana z ciepłem, aby wprowadzić barwnik do komórek i nadać im kolor. Następnie stosuje się barwienie kontrastowe, safraniną, aby nadać kolor bakteriom nieprzetrwalnikującym. Pod koniec zabiegu zarodniki barwią się na zielono, a inne komórki na czerwono. Barwienie metodą Ziehla-Neelsena – w bakteriologii rodzaj techniki diagnostycznej służącej do barwienia prątków. W wyniku barwienia bakterie kwasooporne (prątki) przybierają kolor czerwony pochodzący od fuksyny (nie odbarwiają się one bowiem w kwaśnym alkoholu). Natomiast, śluzy, komórki nabłonka oraz inne bakterie
obecne w preparacie bezpośrednim, niekwasooporne, są wrażliwe na działanie kwaśnego alkoholu, odbarwiają się w nim z fuksyny i wybarwiają się na kolor niebieski od błękitu metylenowego. Metodą tą można też identyfikować promieniowce.
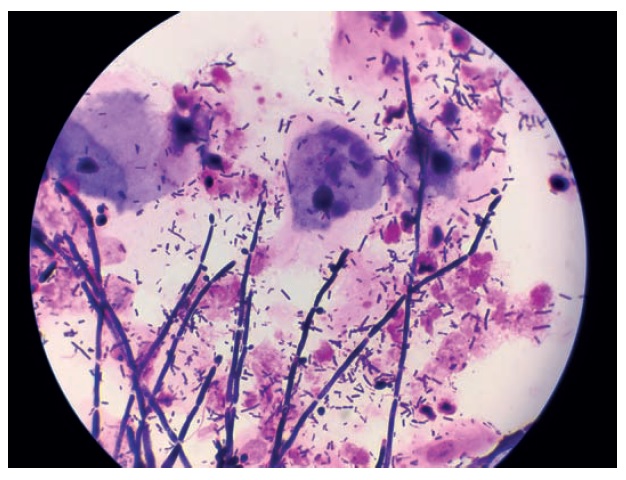
Fot. 3. Mikroflora mieszana – obraz mikroskopowy bakterii gram-ujemnych, gram-dodatnich oraz konidiów grzybów (barwienie złożone)
Wiele ulepszeń technicznych w mikroskopach na przestrzeni lat koncentrowało się na zwiększeniu kontrastu między tym, co interesujące, a tym, co nie jest (tło). Mikroskopia fluorescencyjna jest kwintesencją tego przykładu, ponieważ ma na celu ujawnienie tylko interesujących obiektów na czarnym tle. Ze względu na swoją selektywność obrazowanie fluorescencyjne stało się podstawą mikroskopii w służbie biologii. Mikroskopia fluorescencyjna wymaga zdolności do fluorescencji obiektów zainteresowania. Fluorescencja to emisja światła, która pojawia się w ciągu nanosekund po absorpcji światła, które zwykle ma krótszą długość fali. Cząsteczki, które są wykorzystywane ze względu na ich właściwości fluorescencyjne, nazywane są fluoroforami. Najbardziej zewnętrzne orbitale elektronowe w cząsteczce fluoroforu determinują zarówno jego wydajność jako związku fluorescencyjnego, jak i długości fal absorpcji i emisji. Szeroki zakres spektralny dostępnych fluoroforów umożliwia jednoczesne obrazowanie różnych składników komórkowych, subkomórkowych lub molekularnych. Zastosowanie fluorescencji do badania zjawisk biologicznych szybko rozszerza się na wszystkie dziedziny biologii komórkowej i molekularnej. Podstawowe zasady fizyki i chemii, które leżą u podstaw fluorescencji i fluoroforów, mogą wydawać się dalekie od biologii, ale ich zrozumienie ma kluczowe znaczenie dla dobrej mikroskopii fluorescencyjnej.
Bibliografia
[1] Lichtman J., Conchello J., FLuorescence microscopy. Nature Medthods, 2005.
[2] Faraja A., Godwin P., Gram Staining in the Diagnosis of Acute Septic Arthritis. Acta Orthopedica Belgica, 2002.
[3] Pomorski P., W poszukiwaniu mikroskopu idealnego – rzecz o mikroskopii konfokalnej. Kosmos, 1992.
[4] Snopinśki P., Jarka P., Bilewicz M., Mikroskopia świetlna i konfokalna. LAB, 2017.

