Analityczne problemy ilościowego oznaczania witamin A, E, koenzymu Q10 i kwasu liponowego w próbkach biologicznych
Autor: Monika Joanna Turkowicz1, Joanna Karpińska2
W ostatnich latach, szczególną uwagę, ze względu na działanie prozdrowotne poświęca się związkom o właściwościach antyoksydacyjnych takim jak all-trans retinol, α-tokoferol oraz koenzym Q10 i kwas liponowy. Te powszechnie występujące endogenne lipofilne związki biorą udział w przenoszeniu elektronów w mitochondrialnym łańcuchu oddechowym, przez co odgrywają ważną rolę w metabolizmie organizmów żywych, w tym człowiek
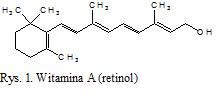
Witamina A, czyli 3,7-dimetylo-9-(2,6,6-trimetylocykloheksen-1-ylo)nona-2,4,6,8-all-trans-tetraen-1-ol należy do lipidów izoprenowych (rys. 1). Jest jednym z 50 istniejących w przyrodzie związków zwanych retinoidami. Ta grupa związków występuje zarówno w świecie zwierzęcym jak i roślinnym. W produktach zwierzęcych jest to retinol i jego pochodne, zaś w produktach roślinnych karotenoidy – prowitaminy A. Podstawowym źródłem witaminy A są przetwory mleczarskie, masło, jaja, wątroba, podroby, trany rybne, oraz ryby, zwłaszcza śledzie, sardynki i tuńczyki [1,2,3]. W świecie roślin dobrym źródłem fizjologicznie czynnych karotenów są przede wszystkim żółte i zielone owoce oraz warzywa, jak np. marchew, nać pietruszki, szpinak, sałata, boćwina, pomidory, banany, morele [3]. Witamina A spełnia w organizmach żywych cały szereg istotnych funkcji. Pobudza wzrost młodych organizmów, reguluje prawidłową czynność skóry i błon śluzowych wpływając na różnicowanie się i czynność nabłonków oraz ich zdolność do regeneracji. Dodatkowo, związki z grupy witaminy A są niezbędne w procesach widzenia, syntezy hormonów kory nadnerczy, wydzielania tyroksyny z tarczycy, utrzymania prawidłowych osłonek nerwowych, reakcji immunologicznych, budowy erytrocytów. Ponadto, jako biologiczne antyoksydanty, zapobiegają powstawaniu nowotworów [1]. W organizmach witamina A magazynowana jest głównie w wątrobie i w niewielkich ilościach w nerkach, tkance tłuszczowej, osoczu, jelicie cienkim, płucach i nadnerczach [1].
Kolejnym związkiem o właściwościach antyoksydacyjnych jest witamina E (rys. 2). Należy do grupy organicznych związków chemicznych, w skład której wchodzą tokoferole i tokotrienole. Ich wspólną cechą jest dwupierścieniowy szkielet 6-chromanolu oraz łańcuch boczny zbudowany z 3 jednostek izoprenowych [4].
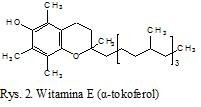
Tokoferole są szczególnie wrażliwe na działanie tlenu i ogrzewanie w temperaturze powyżej 200°C, a obecność metali ciężkich oraz zjełczałych tłuszczów znacznie przyspiesza ich rozkład [1]. Witamina E bardzo dobrze rozpuszcza się w tłuszczach, jest stabilna w świetle widzialnym, ale bardzo wrażliwa na promieniowanie UV [5]. Jest szeroko rozpowszechniona w przyrodzie. Występuje zarówno w świecie roślinnym, jak i zwierzęcym. Bogatym źródłem tego składnika są tłuszcze roślinne, natomiast tłuszcze zwierzęce zawierają jej stosunkowo niewiele. Głównymi źródłami witaminy E są oleje, zwłaszcza z kiełków pszenicznych, sojowy i bawełniany oraz sałata, szpinak, kapusta, masło i jaja [1,3]. Rola witaminy E w organizmie człowieka jest nie do przecenienia. Witamina E, jako naturalny przeciwutleniacz, spełnia rolę wygaszacza wolnych rodników powstających w przemianach metabolicznych (zwłaszcza podczas reakcji utleniania), chroni przed utlenianiem witaminę A i ß-karoten oraz wielonienasycone kwasy tłuszczowe; oraz stabilizuje błony komórkowe. Ze względu na antyoksydacyjną aktywność i działanie ochronne w stosunku do wrażliwych na uszkodzenia elementów komórek, zmniejsza ryzyko powstawania nowotworów. Występuje w osoczu krwi, błonach erytrocytów, dzięki czemu stanowi bezpośrednią ochronę przed peroksydacją lipidów błon komórkowych [4]. Głównym miejscem magazynowania α-tokoferolu są: nadnercza, gruczoły śluzowe, jądra, płytki krwi oraz tkanka tłuszczowa [1]. Witamina E jest również gromadzona w tych narządach, które mają związek z czynnościami rozrodczymi (łożysko, przedni płat przysadki), poza tym w mięśniach, w sercu, wątrobie, płucach.
Podobnym do wyżej omówionych witamin A i E, związkiem poliizoprenoidowym jest koenzym Q10 (ubichinon), czyli 2,3-dimetoksy-5-metylo-6-poliizoprenylobenzo-1,4 benzochinon (rys. 3). Jest rozpuszczalną w tłuszczach, nierozpuszczalną w wodzie pochodną chinonu [6]. Wykazuje odporność na ogrzewanie pod ciśnieniem, dzięki czemu znalazł zastosowanie w przemyśle kosmetycznym (można go dość łatwo wykorzystać w recepturach kosmetycznych). Działa synergistycznie z witaminą E poprzez regenerację rodnika tokoferoksylowego do tokoferolu [7]. Jest skutecznym zmiataczem wolnych rodników oraz wszelkich zalegających w organizmie trucizn. W połączeniu z witaminą E najefektywniej odtruwa komórki z toksyn, a także pomaga skutecznie się ich pozbyć. Również zapobiega oksydacyjnym modyfikacjom białek, lipidów i DNA [8].
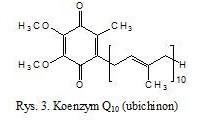
Koenzym Q10 jest niezbędnym ogniwem łańcucha oddechowego odpowiedzialnym za przemiany energetyczne w każdej żywej komórce. Bierze czynny udział w przenoszeniu elektronów. W warunkach prawidłowego funkcjonowania organizmu, w każdej komórce występują w równowadze dwie postaci redoks koenzymu Q10, utleniona – ubichinon i zredukowana ubichinol [8]. We wszystkich tkankach i komórkach organizmu syntetyzowany jest w ilościach wystarczających do wypełniania swojej roli fizjologicznej [9]. W organizmach ubichinon jest produkowany przez wątrobę. W organizmie ludzkim wytwarzany jest z fenyloalaniny i tyrozyny.
Ze względu na powszechność występowania koenzymu Q10 można go znaleźć we wszystkich produktach żywnościowych. Jednak w produktach pochodzenia zwierzęcego zawartość jego jest wyższa niż w produktach roślinnych. Najbogatsze w ten cenny związek są nerki, serce i wątroba, czyli organy o największym zapotrzebowaniu energetycznym. Małe ilości tego związku stwierdzano w warzywach, owocach oraz nabiale [9].
Kolejnym z głównych przeciwutleniaczy jest kwas liponowy. Ze względu na obecność asymetrycznego atomu węgla jest związkiem optycznie czynnym (rys. 4). Naturalnie występujący kwas α-liponowy ma konfigurację R i jest prawoskrętny [10]. Związek ten, jak i jego zredukowana postać kwas dihydroliponowy (DHLA), działa jako bezpośredni zmiatacz wolnych rodników. Kwas liponowy jest łatwo rozpuszczalny w wodzie oraz w tłuszczu. W związku z tym jest obecny w osoczu, cytoplazmie i w błonach komórkowych.
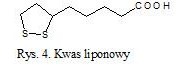
Początkowo sądzono, że kwas liponowy jest witaminą i musi być dostarczany z pożywieniem. Jednak później okazało się, że może być syntetyzowany zarówno przez rośliny jak i zwierzęta, a także przez człowieka. Bierze udział w redukcji rodnika tokoferolu, utlenionej formy witaminy C, glutationu jak również koenzymu Q10. Wykazuje zdolność do chelatowania jonów metali oraz regeneracji zredukowanych postaci innych drobnocząsteczkowych przeciwutleniaczy, takich jak witaminy C i E [11]. Reguluje poziom cukru we krwi, zapobiegając odkładaniu się tłuszczu. W organizmie ludzkim kalorie z jedzenia kieruje do procesów energetycznych, a nie do procesów budowania tkanki tłuszczowej. Doskonałymi źródłami pochodzenia kwasu liponowego są: mięso, podroby (zwłaszcza wątroba), warzywa w szczególności brokuły i szpinak oraz drożdże.
Kontrola zawartości omawianych związków w żywności jest niezwykle ważna z punktu widzenia oszacowania poziomu ich dziennego pobrania. Pozwala na ocenę zbilansowania przeciętnej diety oraz jej prozdrowotnych aspektów. Badania zawartości antyoksydantów we krwi pacjentów dają obraz poziomu stresu oksydacyjnego [12] oraz ogólnego stanu zdrowia. Ten cel analityczny jest najczęściej realizowany za pomocą różnych metod chromatograficznych.
Niektóre opisane w literaturze procedury pozwalają na oznaczanie pojedynczego składnika. Inne, ze względu na swój charakter, umożliwiają oznaczanie kilku składników równocześnie. Te ostatnie ze względu na oszczędność materiałów oraz czasu analizy stają się coraz bardziej popularne. Jednak jednoczesne oznaczanie kilku składników w złożonych matrycach niesie za sobą pewne trudności. Mogą one być związane z właściwym wyizolowaniem oznaczanych związków, oczyszczeniem próbek ze składników przeszkadzających. Problematyczne może być także uzyskanie stabilności oznaczanych związków oraz przeprowadzenie ich w formę zgodną z końcową techniką analityczną.
Trudności w ilościowym oznaczaniu witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10 w produktach spożywczych sprawia ich wrażliwość na czynniki fizykochemiczne. Dlatego też niektórzy autorzy zalecają w trakcie analizy ochronę przed światłem próbek zawierające witaminy oraz koenzym Q10 [13,14], jak również stosowanie obniżonej temperatury ekstrakcji przy oznaczaniu all-trans retinolu [15,16].
Niezależnie od końcowego sposobu identyfikacji, ważnym jest właściwe pobranie oraz przygotowanie próbek do badań. Próbka powinna być reprezentatywna w stosunku do całej partii materiału. Podczas pobierania, transportu i przechowywania próbki powinny być chronione przed przypadkowym zanieczyszczeniem, ponieważ może to niewłaściwie wpływać na poprawność końcowego wyniku analizy. Odpowiednie przygotowanie próbki do analizy wymaga oczyszczenia, wyodrębnienia z matrycy składników, które mają być w następnej kolejności oznaczane. Rodzaj matrycy oraz technika oznaczania składników determinują sposób przygotowania próbek.
Wielu autorów łączy kilka technik oczyszczania jednocześnie. Im bardziej skomplikowana matryca, tym proces przygotowania próbki staje się bardziej złożony, wieloetapowy. Często pierwszym etapem przygotowania próbek jest hydroliza. Hydrolizę alkaliczną (zmydlanie) za pomocą wodorotlenku potasu zastosowano do wydzielenia witaminy E z próbek osocza ludzkiego [17]. Tę samą substancję wykorzystano do wstępnego przygotowania próbek żywności w celu jednoczesnego wydzielenia witaminy A oraz E [18]. Hydrolizą kwasową, za pomocą kwasu siarkowego (VI), poprzedzono etap ekstrakcji kwasu liponowego z próbek żywności [19]. Kwas chlorowodorowy zastosowano do hydrolizy próbek przed etapem ekstrakcji witamin A, E i kwasu liponowego z preparatów multiwitaminowych [20]. ε-pochodną lizyny, zastosowano do przygotowania próbek osocza ludzkiego zawierających kwas liponowy [21]. β-glukuronidazę wykorzystano do hydrolizy próbek moczu ludzkiego zawierających witaminę E [22].
Trudności w wydzielaniu poszczególnych składników z próbek może powodować zawartość białka. Dlatego też wielu autorów sugeruje włączenie do procedury przygotowania próbek etapu odbiałczania. W analizie kwasu liponowego do wytrącenia przeszkadzających białek z próbek krwi stosowano acetonitryl [23]. 2-propanol został wykorzystany w procedurze oznaczania koenzymu Q10 do odbiałczania surowicy szczurów [24]. W przypadku oznaczania witaminy E oraz koenzymu Q10 w próbkach diet eskimosów zastosowano mieszaninę metanol-etanol (1:1) [25]. W przypadku jednoczesnego oznaczania witaminy A, E oraz koenzymu Q10 w osoczu krwi ludzkiej do odbiałczania wykorzystano metanol [26]. Do wstępnego przygotowania próbek w analizie witaminy A [27] oraz w jednoczesnym oznaczaniu witamin A oraz E w środkach farmaceutycznych [28] stosowano DMSO jako substancję odbiałczającą.
Procesowi ekstrakcji witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10 mogą towarzyszyć dodatkowe, niepożądane reakcje chemiczne, np. izomeryzacja retynoli, transformacja cholekalcyferolu i alfakalcydolu w tachysterol [29]. W związku z powyższym stosuje się antyutleniacze i stabilizatory. Mogą one być naturalnym składnikiem próbek lub są celowo dodawane w trakcie analizy. Do naturalnych antyutleniaczy należą kwas askorbinowy (witamina C) oraz tokoferol (witamina E). Natomiast w analizach witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10 najczęściej stosowanym antyutleniaczem jest 2,6-di-tert-butylo-4-metylofenol (BHT). Stosowano go w analizie witaminy A [16], witaminy E [17,30], w procedurze jednoczesnego oznaczania mieszanin dwuskładnikowych: witaminy A oraz E [14,18,31,32] oraz w analizach mieszanin trójskładnikowych: witaminy A i E oraz koenzymu Q10 [33,34]. W literaturze można też spotkać przypadki oznaczania witaminy E z zastosowaniem 2-tert-butylo-4-metylofenolu (BHA) jako antyutleniacza [30]. Podczas jednoczesnego oznaczania witaminy A oraz E wykorzystano dodatek kwasu askorbinowego [18,28] w celu ochrony analitów przed utlenieniem. W trakcie analizy witaminy A przeprowadzono badania efektywności stosowanych antyutleniaczy: kwasu askorbinowego i BHT. Znacznie lepszą stabilność oraz ochronę przed utlenianiem uzyskano w przypadku zastosowania BHT [14].
Podczas analizy materiału biologicznego (krew, osocze) ważnym jest aby nie dopuścić do krzepnięcia próbek. Dlatego też w takich przypadkach dodaje się antykoagulanty, np. uwodniony cytrynian trisodowy do konserwacji próbki przed oznaczeniem kwasu liponowego [21].
Najczęściej stosowaną w literaturze techniką wyodrębniania z próbek zawierających witaminę A, witaminę E, kwas liponowy oraz koenzymu Q10 jest ekstrakcja. Z próbek żywności, jako pojedynczy składnik ekstrahowano witaminę A w układzie ciecz-ciecz za pomocą acetonu [15] oraz etanolu [16]. Witaminę E w układzie ciecz-ciecz wydzielano metanolem [30] oraz heksanem [35]. W przypadku kwasu liponowego w literaturze można odnaleźć wiele technik wyodrębniania oznaczanego składnika. Najczęściej stosowanym ekstrahentem do wydzielenia kwasu liponowego z próbek żywności są eter dietylowy [19], benzen [36], 1% roztwór lodowatego kwasu octowego w metanolu [37]. Z próbek krwi i tkanek mózgu szczura kwas liponowy ekstrahowano tert-butylometyloeterem, octanem etylu lub dichlorometanem [23]. n-heksan [33], acetonitryl [38] zastosowano do wydzielenia kwasu liponowego z próbek osocza ludzkiego. W doniesieniach literaturowych można również odnaleźć metody wyodrębnienia kwasu liponowego z ludzkiego osocza przy zastosowaniu ekstrakcji w układzie ciecz-ciało stałe ekstrahując metanolem próbkę z kolumienek C-18 [21].
Zawartość koenzymu Q10 jest oznaczana zarówno w próbkach materiału biologicznego (surowica ludzka) [12] jak również w próbkach żywności [39,40,41]. Do ekstrakcji koenzymu Q10 z próbek żywności w układzie ciecz-ciecz zastosowano 2-propanol [40]. Podobnie jak kwas liponowy, koenzym Q10 z powodzeniem oczyszczano stosując ekstrakcję w układzie ciecz-ciało stałe, wymywając z kolumienek SPE (C-18) mieszaniną heptan:eter dietylowy (80:20 v/v) [42].
Witaminy A, E, koenzym Q10 i kwas liponowy różnią się pod względem budowy chemicznej i polarności. Różnice te powodują trudności w jednoczesnym oznaczaniu witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10. Niewiele jest prac badawczych poświęconych opracowaniu procedur jednoczesnego wydzielania i oznaczania tych związków. Najczęściej można spotkać prace dotyczące jednoczesnego oznaczania witaminy A oraz E. Do wydzielenia tych składników z materiału biologicznego (surowica ludzka) stosowano mieszaninę n-heksan:dichlorometan (70:30 v/v) [31]. W innej procedurze autorzy zalecają jako najbardziej optymalne stosowanie rozpuszczalników n-heksanu oraz dichlorometanu w dwóch etapach. W pierwszym etapie dodano czysty n-heksan, a następnie bez zlewania fazy organicznej, dodano dichlorometan [14]. W innej procedurze do jednoczesnej ekstrakcji witaminy A oraz E z próbek żywności zaproponowano n-heksan [18]. Z próbek mięsa drobiowego witaminy A oraz E ekstrahowano mieszaniną n- heksan:izopropanol (3:2 v/v) [32].
Witaminę E oraz koenzym Q10 oznaczano w próbkach diet Eskimosów. Oba składniki wydzielano jednocześnie za pomocą n-heksanu [25].
Niewiele jest prac poświęconych jednoczesnemu oznaczaniu trzech składników. Zawartość witamin A, E oraz koenzymu Q10 oznaczono w materiale biologicznym (osocze oraz surowica ludzka) ekstrahując n-heksanem [26,34]. Te same związki wydzielono z multiwitaminowego suplementu diety za pomocą mieszaniny eter naftowy:octan etylu:metanol (1:1:1 v/v/v) [13]. Inna procedura [20] zaleca zastosowanie sekwencji rozpuszczalników: octanu etylu i dodatku etanolu, do jednoczesnego wydzielania α-tokoferolu, all-trans retinolu oraz kwasu liponowego z preparatu multiwitaminowego.
Otrzymane ekstrakty powinny być pozbawione substancji przeszkadzających, a także maskujących oznaczane składniki. W przypadku prac na czystych substancjach wzorcowych nie ma to tak dużego znaczenia jak w przypadku matryc o złożonej wieloskładnikowej budowie takich jak np.: mieszanki mleczne, a nawet całodzienne racje pokarmowe. W zależności od składu matrycy można zastosować różne sposoby oczyszczania. W przypadku próbek zawierających w składzie niewielkie ilości tłuszczy np. środki farmaceutyczne lub niskotłuszczowe środki spożywcze, oznaczano witaminę A, witaminę E, kwas liponowy oraz koenzym Q10 przy zastosowaniu ekstrakcji w łaźni ultradźwiękowej. W ten sposób izolowano pojedyncze składniki np. kwas liponowy [37] jak również kilka składników jednocześnie: witaminę A oraz E [43] oraz witaminę A, E i koenzym Q10 [13].
Niektóre procedury opisujące przygotowanie próbek stosują ekstrakcję ciecz-ciecz połączoną z ogrzewaniem rozpuszczalnika w celu jego odparowania i jednoczesnego zagęszczenia ekstraktu całej próbki pod zmniejszonym ciśnieniem. Takie rozwiązanie przyjęto do wydzielenia analitów w celu jednoczesnego oznaczania witaminy A, E oraz koenzymu Q10 [13], witaminy A oraz E [32], a także przy oznaczaniu samego koenzymu Q10 [41].
Ostatnim etapem przygotowania próbek jest redukcja objętości wydzielonych ekstraktów. Osiągane jest to poprzez wysuszenie w łagodnym strumieniu gazu obojętnego, a następnie rozpuszczenie suchych ekstraktów w małej objętości odpowiedniego rozpuszczalnika. Ekstrakty zawierające witaminę A [15], kwas liponowy [21,44], koenzym Q10 [12,42], witaminy E i A [25] odparowywano w łagodnym strumieniu azotu. Niekiedy do tego celu stosowany jest argon (oznaczanie witamin A i E) [17].
W literaturze odnaleźć można prace poświęcone metodom analitycznym oznaczania witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10, począwszy od mniej skomplikowanych (spektrofotometria, fluorymetria, kolorymetria) do bardziej popularnych, czułych i selektywnych metod chromatografii gazowej, wysokosprawnej chromatografii cieczowej HPLC czy też ultra wysokosprawnej chromatografii cieczowej UHPLC. W tabeli 1 przedstawiono przegląd opisanych w literaturze metod oznaczania witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10 z uwzględnieniem rodzaju matrycy w jakim były oznaczane związki.
Wysokosprawna chromatografia cieczowa HPLC
Najpopularniejszą techniką w analizie omawianych związków jest wysokosprawna chromatografia cieczowa, najczęściej w odwróconym układzie faz. Do rozdziału najczęściej wykorzystywane są kolumny C-18. Wypełnienie oktadecylowe wykorzystano do oznaczeń witaminy A [16], kwasu liponowego [36,37,44], oraz w oznaczaniu kilku składników jednocześnie tj. witamin A i E [18,31], witaminy A, E oraz koenzym Q10 (w zakresie: witamina A 0,09mg/L-10,0mg/L, witamina E 0,9mg/L-100mg/L, koenzym Q10 0,14mg/L-15mg/L) [34]. Jako fazy ruchome najczęściej stosowane są mieszaniny wody (z dodatkiem kwasu octowego lub trifluorooctowego) i acetonitrylu lub/i metanolu w różnych proporcjach. Do oznaczania koenzymu Q10 stosowano mieszaninę wody i acetonitrylu [34]. Kwas liponowy oznaczano stosując mieszaniny acetonitryl:metanol:woda w zakresie 0,75µM-120µM [45], metanol:woda:kwas octowy [19]. Do jednoczesnej analizy witamin A i E wykorzystywano jako fazę ruchomą mieszaninę metanol:woda [14,31], acetonitryl:metanol [17] oraz acetonitryl:metanol:woda [18]. W przypadku jednoczesnej analizy witaminy A i E oraz koenzymu Q10 stosowano mieszaniny metanol:woda [13], metanol:n-heksan [26]. Fazę ruchomą acetonitryl: metanol:tert-butanol stosowano w jednoczesnym oznaczaniu witaminy A i E oraz koenzymu Q10 [33].
Do wykrywania związków lub ich grup w HPLC stosuje się różne rodzaje detektorów. Najczęściej stosowanymi detektorami są detektory spektrofotometryczne (UV). Detektory te stosowano do wykrywania pojedynczych składników tj. witamina A [46], kwas liponowy [47], koenzym Q10 [48], a także do mieszanin wieloskładnikowych np. witaminy A oraz E [14,18,49], witaminy A, E oraz koenzym Q10 [26,34]. Detektor spektrofotometryczny z matrycą fotodiodową (DAD) zastosowano do oznaczania koenzymu Q10 przy długości fali 275nm [41], jednoczesnego wykrywania witamin A i E przy długości fali 450 i 290nm [17] oraz oznaczania witamin A, E i koenzymu Q10 przy długości fali 450 i 280nm [13]. Często stosowanymi detektorami są detektory elektrochemiczne [21]. Detektor kulometryczny wykorzystano do oznaczania wyekstrahowanego z próbek żywności kwasu liponowego [37] oraz do jednoczesnego oznaczania koenzymu Q10 oraz witaminy E [25].
Detektor fluorescencyjny (FD) stosowano do wykrywania witaminy A [35], kwasu liponowego [50,51] oraz przy jednoczesnym oznaczaniu witaminy A i E [17]. Rzadziej spotykane, ale nie mniej pomocne są detektory wychwytu elektronów (ECD), za pomocą których wykrywano kwas liponowy [44] a także koenzym Q10 [40].
Ostatnio, coraz częściej do analizy witamin lipofilnych stosuje się chromatografię cieczową sprzężoną ze spektrometrią mas (MS). Za pomocą tej metody oznaczano kwas liponowy [38] oraz koenzym Q10 [12,42].
Chromatografia gazowa GC
Podobnie jak HPLC szeroko stosowaną metodą rozdziału jest chromatografia gazowa. Najczęściej wykorzystywane są tradycyjne kolumny wypełnione silikażelem lub kolumny kapilarne wykonane z topionej krzemionki wypełnione polimerem [32]. Jako gazy nośne stosowany jest zazwyczaj hel [19], azot [36] lub wodór. W przypadku analiz ilościowych badanych witamin najczęściej wykorzystywany jest detektor płomieniowo-jonizacyjny (FID). W chwili obecnej technika GC-MS jest uważana za szybką i pozwalającą na uzyskanie wiarygodnych wyników. Techniką tą oznaczano kwas liponowy w ogólno dostępnym w handlu mięsie w zakresie 10pg/µl-20ng/µl [19], witaminy A i E w mięsie drobiowym [32].
W celu poprawienia parametrów procesu chromatograficznego, takich jak selektywność, rozdzielczość, kształt sygnału stosuje się derywatyzację. Proces ten polega na przeprowadzeniu analitów, w wyniku reakcji chemicznej, w odpowiednie pochodne o właściwościach umożliwiających ich oznaczenie. W analizie kwasu liponowego do derywatyzacji zastosowano N-metylo-N-tert-butylodimetylosilil-trifluoroacetamid (MBDSTFA) [19], ester S,S-dietoksykarbonylometylu (S,S-DEOC metylo ester), N-(tert-butylodimetylosililo)-N-metylotrifluoroacetamid (MTBSTFA) [36], N-(1-pyreno)jodoacetamid [45]. Derywatyzację eterem trimetylosililowym zastosowano przy jednoczesnym oznaczaniu witaminy A oraz E [32]. Należy jednak pamiętać, pomimo że derywatyzacja zwiększa stabilność termiczną i poprawia kształt piku, może jednocześnie prowadzić do całkowitego rozkładu witamin [32].
Kapilarna elektroforeza CE
wego oznaczania witamin jest wykorzystywana wysokosprawna elektroforeza kapilarna. Metodą tą oznaczano kwas liponowy stosując detektor UV przy długości fali 214nm [36] oraz witaminę A w próbkach żywności stosując detektor spektrofotometryczny [52].
Do rzadziej spotykanych w literaturze sposobów oznaczania należą metody chemiluminescencyjne oraz woltamperometryczne i kulometryczne miareczkowanie. Pierwszą z nich wykorzystano do jednoczesnego oznaczania witaminy A i E w zakresie od 5,0·10-8M do 5,0·10-6M [43]. Natomiast za pomocą woltamperometrycznego i kulometrycznego miareczkowania oznaczano kwas liponowy w zakresie od 1,15·10-5M do 1,73·10-4M [53].
Tabela 1. Metody oznaczania witaminy A, witaminy E, kwasu liponowego oraz koenzymu Q10
z uwzględnieniem rodzaju matrycy
|
Oznaczany składnik |
Rodzaj matrycy |
Metoda analityczna |
Literatura |
|
witamina A |
ludzkie osocze |
HPLC z detektorem UV |
[46] |
|
rybia ikra |
LC-MS |
[15] |
|
|
owocowe pulpy |
HPLC |
[16] |
|
|
witamina E |
makaron |
mikroemulsyjna elektrokinetyczna chromatografia |
[30] |
|
mleko ludzkie |
UHPLC z detektorem fluorescencyjnym |
[35] |
|
|
kwas liponowy |
czyste substancje wzorcowe |
woltamperometryczne |
[53] |
|
mięso dostępne w handlu (wołowina, cielęcina, baranina oraz wieprzowina) |
chromatografia GC/MS |
[19] |
|
|
jaja kurze, majonez, ziemniaki, groszek w puszkach |
HPLC z detekcją kulometryczną |
[37] |
|
|
ludzkie osocze |
HPLC z detektorem ECD |
[44] |
|
|
ludzkie osocze |
HPLC z detektorem elektrochemicznym |
[21] |
|
|
ludzkie osocze |
HPLC-ESI-MS |
[38] |
|
|
tkanki myszy oraz szczura |
HPLC z detektorem fluorescencyjnym |
[50] |
|
|
krew i tkanki mózgu szczura |
LC/MS/MS |
[23] |
|
|
czyste substancje wzorcowe |
HPLC z detektorem fluorescencyjnym |
[51] |
|
|
preparaty farmaceutyczne, |
HPLC UV/vis FIP |
[47] |
|
|
bakterie, tkanki, |
GC, GC/MS, HPLC oraz elektroforeza kapilarna |
[36] |
|
|
koenzym Q10 |
ryby |
HPLC z detektorem PDA |
[39] |
|
środki spożywcze pochodzenia zwierzęcego i roślinnego (8 typów mięsa, 16 typów ryb i owoców morza, 21 warzyw, 7 owoców, 6 warzyw strączkowych, 3 typy ziemniaków, 3 mleczne produkty) |
HPLC z detektorem ECD |
[40] |
|
|
mięso, drób, ryby, olej rzepakowy |
HPLC z detekcją fotodiodową |
[41] |
|
|
oleje roślinne |
HPLC sprzężony z MS |
[42] |
|
|
ludzkie osocze |
HPLC z detektorem UV |
[48] |
|
|
czyste substancje wzorcowe |
woltamperometria |
[54] |
|
|
surowica ludzka podczas stresu oksydacyjnego |
LC-MS-MS |
[12] |
|
|
witamina E oraz koenzym Q10 |
dieta Eskimosów |
HPLC z detekcją kulometryczną |
[25] |
|
witaminy A oraz E |
ludzkie osocze |
HPLC z detektorem fluorescencyjnym oraz diodowym |
[8] |
|
surowica ludzka |
chemiluminescencja |
[43] |
|
|
surowica ludzka |
HPLC z detektorem UV |
[14, 31,55] |
|
|
mieszanki mleczne dla niemowląt |
HPLC z detektorem UV |
[18] |
|
|
tkanki drobiu |
GC/MS |
[32] |
|
|
kosmetyki z dodatkiem filtrów UV |
HPLC z detektorem UV |
[49] |
|
|
witaminy A i E oraz kwas liponowy |
multiwitaminowy suplement diety |
HPLC |
[20] |
|
witaminy A i E oraz koenzym Q10 |
multiwitaminowy suplement diety |
HPLC z detekcją fotodiodową, LC/MS |
[13] |
|
osocze oraz surowica ludzka |
HPLC oraz UHPLC z detektorem UV |
[26,34] |
Literatura
- J. Gawędzki, Żywienie człowieka Podstawy nauki o żywieniu, Wydawnictwo Naukowe PWN, Wydanie III, Warszawa, (2010)
- M. Rutkowski; K. Grzegorczyk, Witaminy o działaniu antyoksydacyjnym – ogólna charakterystyka. Część I: witamina A, Postępy farmakoterapii, (1998), 54, 16, 739-743
- Z.E. Sikorski, Chemia żywności. Skład, przemiany i właściwości żywności, Wydawnictwo Naukowo-Techniczne, Wydanie III, Warszawa, (2000)
- E. Bielak; K. Pasternak, Biologiczna rola witaminy E, Bromat. Chem. Toksykol., (2001), 1, 29-33
- M. Rutkowski; K. Grzegorczyk, Witaminy o działaniu antyoksydacyjnym – ogólna charakterystyka. Część II: witamina E, Farmacja polska, (1998), 54, 18, 838-842
- A. Danysz; A. Kwieciński, Właściwości farmakologiczne i lecznicze koenzymu Q10, Informacja o leku, (1997), 53, 13, 589-597
- E. Sosińska; R. Wołosiak, Aktywność przeciwutleniająca koenzymu Q10, fitosteroli oraz glutationu w reakcji autooksydacji emulsji tłuszczu roślinnego, Żywność. Nuka. Technologia. Jakość, (2006), 2(47), 334-341
- E. Siemieniuk; E. Skrzydlewska, Koenzym Q10 – biosynteza i znaczenie biologiczne w organizmach zwierząt i człowieka, Postępy Hig. Med. Dośw. (online), (2005), 59, 150-159
- U. Gałka; J. Ogonowski, Koenzym Q – powstawanie, właściwości i zastosowanie w preparatach kosmetycznych, LAB, (2010), 15, 5, 14-21
- A. Bilska; L. Włodek, Biologiczne właściwości kwasu liponowego, Postępy Hig. Med. Dośw., (2002), 56, 2, 201-219
- D. Malińska; K. Winiarska, Kwas liponowy – charakterystyka i zastosowanie w terapii, Postępy Hig. Med. Dośw. (online), (2005), 59, 535-543
- J. Ruiz-Jimenez; F. Priego-Capote; J.M. Mata-Granados; J.M. Quesada; M.D. Luque de Castro, Determination of the ubiquinol-10 and ubiquinone-10 (coenzyme Q10) in human serum by liquid chromatography tandem mass spectrometry to evaluate the oxidative stress, J. Chrom. A, (2007), 1175, 242-248
- Dietmar E. Breithaupt; Stefanie Kraut, Simultaneous determination of the vitamins A,E, their estere and coenzyme Q10 in multivitamin dietary supplements using an RP-C30 phase, Eur Food Res Technol, (2006), 222, 643-649
- M.I. Khan; A. Khan; Z. Iqbal; L. Ahmad; Y. Shah, Optimization and Validation of RP-LC/UV-VIS Detection Method for Simultaneous Determination of Fat-Soluble Anti-Oxidant Vitamins, all-trans-Retinol and a-thocopherol in Human Serum: Effect of Experimental Parameters, Chromatographia, (2010), 71, 577-586
- H. Li; S.T. Tyndale; D.D. Heath; R.J. Letcher, Determination of carotenoids and all-trans-retinol in fish eggs by liquid chromatography-electrospray ionization-tandem mass spectrometry, J. Chrom. B, (2005), 816, 49-56
- M.W. Davey; J. Keulemans; R. Swennen, Methods for the efficient quantifikation of fruit provitamin A contents, J. Chrom. B, (1997), 695, 209-215
- O. Sommerburg; L. Zang; F.J.G.M. van Kuijk, Simultaneous detection of carotenoids and vitamin E in human plasma, J. Chrom. B, (2006), 1136, 176-184
- S. Albala-Hurtado; S. Novella-Rogriguez; M.T. Veciana-Nogues; A. Marine-Font, Determination of vitamins A and E in infant milk formulae by high-performance liquid chromatography, J. Chrom. A, (1997), 778, 243-246
- A. Mattulant; W. Baltes, Determination of lipoic acid in meat of commercial quality, Z Lebensm Unters Forsch, (1992), 194, 326-329
- E.I. Kozlov; I.A. Solunina; M.L. Lyubareva; M.A. Nadtochii, HPLC determination of lipoic acid and vitamins A and E in multivitamin compositions, Pharm. Chem. J., (2004), 38, 11, 55-56
- J. Teichert; R. Preiß, Determination of lipoic acid in human plasma by high-performance liquid chromatography with elektrochemical detection, J. Chrom. B, (1995), 672, 277-281
- J.L. Luque-Garcia; M.D. Luque de Castro, Extraction of fat-soluble vitamins, J. Chrom. A, (2001), 935, 3-11
- H.T. Chng; L.S. New; A.H. Neo; C.W. Goh; E.R. Browne; E.C.Y. Chan, A sensitive LC/MS/MS bioanalysis assay administered lipoic acid in rat blood and brain tissue, J. P. Biomed. Anal., (2010), 51, 754-757
- L. Li; D. Pabbisetty; P. Carvalho; M.A. Avery; B.A. Avery, Analysis of Co Q10 in rat serum by ultra-performance liquid chromatography mass spectrometry after oral administration, Journal of Pharmaceutical and Biomedical Analysis (2008), 46, 137-142
- M. Belanger; M. Mirault; E. Dewailly; L. Berthiaume; P. Julien, Environmental contaminants and redox status of doenzyme Q10 and vitamin E in Inuit from Nunavik, Met.Clin. Exp., (2008), 57, 927-933
- J. Karpińska; B. Mikołuć; R. Motkowski; J. Piotrowska-Jastrzębska, HPLC method for simultaneous determination of retinol, α-tocopherol and coenzyme Q10 in human plasma, J. Pharm. Biomed. Anal., (2006), 42, 232-236
- N. Davydova; E. Stippler; P. Jin; G. Giancaspro, Development and validation of a dissolution test method for vitamin A in cietary supplement tablets, Journal of Pharmaceutical and Biomedical Analysis, (2010), 53, 295-301
- F. Momenbeik; M. Roosta; A.A. Nikoukar, Simultanoeus microemulsion liquid chromatographic analysis of fat-soluble vitamins in pharmaceutical formulations: optimization using genetic algorithm, J. Chrom. A, (2010), 1217, 3770-3773
- S. Wieliński; A. Olszanowski, Wykorzystanie HPLC do oznaczania witamin rozpuszczalnych w tłuszczach, Wiadomości chemiczne, (2001), 55, 11-12
- V. Darji; M.C. Boyce; I. Bennett; M.C. Breadmore; J. Quirino, Determination of food grade antioxidants using microemulsion electrokinetic chromatography, Electrophoresis, (2010), 31, 2267-2271
- A. Khan; M.I. Khan; Z. Iqbal; Y. Shah; L. Ahmad; D.G. Watson, An optimized and validated RP-HPLC/UV detection method for simultaneous determination of all-trans-Retinol (Vitamin A) and α-Tocopherol (Vitamin E) in human serum: Comparison of different particulate reversed-phased HPLC columns, J. Chrom. B, (2010), 878, 2339-2347
- C. Maraschiello; J.A. Garcia Regueiro, Procedure for the determination of retinol and a-tocopherol in poultry tissues using capillary gas chromatography with solvent venting injection, J. Chrom. A, (1998), 818, 109-121
- B.L. Lee; C.N. Ong, Comprehensive high- performance liquid chromatographic method for the measurements of lipophilic antioxidants in human plasma, J. Chrom. A, (2009), 1216, 3131-3137
- E. M. Paliakov; B.S. Crow; M.J. Bishop; D. Norton, Rapid quantitative determination of fat-soluble vitamins and coenzyme Q10 in human serum by reversed ultra-high pressure liquid chromatography with UV detection, J. Chrom. B, (2009), 877, 89-94
- C. Molto-Puigmarti; M. Permanyer; A.I. Castellone; M. C. Lopez-Sabater, Effects of pasteurisation and high-pressure processing on vitamin C, tocopherols and fatty acids in mature human milk, Food Chem., (2011), 124, 697-702
- H. Kataoka, Chromatographic analysis of lipoic acid and related compounds, J. Chrom. B, (1998), 717, 247-262
- A. I. Durrani; H. Schwartz; M. Nagl; G. Sontag, Determination of free α-lipoic acid in foodstuffs by HPLC coupled with CEAD and ESI-MS, Food Chemistry, (2010), 120, 1143-1148
- J. Chen; W. Jiang; J. Cai; W. Tao; X. Gao; X. Jiang, Quantification of lipoic acid in plasma by high-performance liquid chromatography-electrospray ionization mass spectrometry, J. Chrom. B, (2005), 824, 249-257
- N. Souchet; S. Laplante, Seasonal variation of Co-enzyme Q10 content in pelagic fish tissues from Eastern Quebec, J. Food Comp. Anal., (2007), 20, 403-410
- H. Kubo; K. Fujii; T. Kawabe; S. Matsumoto; H. Kishida; K. Hosoe, Food content of ubiquinol-10 and ubiquinone-10 in the Japanese diet, J. Food Comp. Anal., (2008), 21, 199-210
- P. Mattila; J. Kumpulainen, Coenzymes Q9 and Q10: Contents in Foods and Dietary Intake, Journal of Food Composition and Analysis, (2001), 14, 409-417
- R. Rodriguez-Acuna; E. Brenne; F. Lakoste, Determination of Coenzyme Q10 and Q9 in Vegetable Oils, J. Agr. Food Chem., (2008), 56, 15, 6241-6245
- A. Waseem; L. Rishi; M. Yaqoob; A. Nabi, Flow-Injection Determination of Retinol and Tocopherol in Pharmaceuticals with Acidic Potassium Permanganate Chemiluminescence, Anal. Sci., (2009), 25, 407-412
- A. Khan; M. I. Khan; Z. Iqbal; L. Ahmad; Y. Shah; D.G. Watson, Determination of lipoic acid in human plasma by HPLC-ECD using liquid-liquid and solid-phase extraction: Method development, validation and optimization of experimental parameters, J. Chrom. B, (2010), 878, 2782-2788
- T. Inoue; M. Sudo; H. Yoshida; K. Todoroki; H. Nohta; M. Yamaguchi, Liquid chromatographic determination of polythiols based on pre-column excimer fluorescence derivatization and its application to α-lipoic acid analysis, J. Chrom. A, (2009), 1216, 7564-7569
- K. Hozyasz; M. Chełchowska; Z. Surowiec, Stężenia cholesterolu i retinolu u kobiet, które urodziły dziecko z izolowanym rozszczepieniem podniebienia – doniesienie wstępne, Dent. Med. Probl., (2005), 42, 2, 299-302
- M.N. Abbas; A.A. Radwan, Novel lipoate-selective membrane sensor for the flow injection determination of α-lipoic acid in pharmaceutical preparations and urine, Talanta, (2008), 74, 1113-1121
- P. Kaplan; N. Sebestianowa; J. Turiakowa; I. Kucera, Determination of coenzyme Q in human plasma, Physiol. Res., (1996), 45, 39-45
- L. Rigo Gaspar; P.M. Berardo Goncalves Maia Campos, A HPLC method to evaluate the influence of photostabilizers on cosmetic formulations containig UV-filters and vitamins A and E, Talanta, (2010), 82, 1490-1494
- S. Satoh; M. Shindoh; J.Z. Min; T. Toyo’oka; T. Fukushima; S. Inagaki, Selective and sensitive determination of lipoyllysine (protein-bound α-lipoic acid) in biological specimens by high-performance detection, Anal. Chim. Acta, (2008), 618, 210-217
- S. Satoh; T. Toyo’oka; T. Fukushima; S. Inagaki, Simultaneous determination of α-lipoic acid and its reduced form by high-performance liquid chromatography with fluorescence detection, J. Chrom. B, (2007), 854, 109-115
- E. Cieślik; A. Niedośpiał; B. Mickowska, Wykorzystanie elektroforezy kapilarnej w analizie żywności, Żywność. Nauka. Technologia. Jakość, (2008), 2(57), 5-14
- G.K. Ziyatdinova; G.K. Budnikov; V.I. Pogorel’tsev, Elektochemical Determination of Lipoic Acid, J. Anal. Chem., (2004), 59, 3, 288-290
- G. Wittstock; H. Emons, Voltamperometric Determination of Ubiquinone Adsorption at Mercury Electrodes, Electroanalysis, (1997), 9,6, 449-453
- M. Chełchowska; J. Ambroszkiewicz; W. Klemarczyk; J. Gajewska; M. Ołtarzewski; T. Laskowska – Klita, Wpływ stosowania diety wegetariańskiej na stężenie homocysteiny oraz całkowitą aktywność przeciwutleniającą w surowicy u dzieci, Pol. Merk. Lek., (2010), 29, 171, 177
1mgr Monika Joanna Turkowicz, Sekcja Badań Żywności, Przedmiotów Użytku i Struktury Żywienia, Wojewódzka Stacja Sanitarno – Epidemiologiczna w Białymstoku (autor do korespondencji)
e-mail: monika.turkowicz@wp.pl(link sends e-mail)
2dr hab. Joanna Karpińska, prof. UwB, Instytut Chemii, Uniwersytet w Białymstoku
e-mail: joasia@uwb.edu.pl(link sends e-mail)

