Mikroplastiki – nowe zanieczyszczenia ekosystemów wodnych
Autor: Paulina Piskuła, Aleksander Astel*
Tworzywa sztuczne, zwane potocznie plastikami stanowią grupę materiałów, które otrzymuję się poprzez połączenie polimerów ze związkami pomocniczymi. Do związków pomocniczych należą barwniki, stabilizatory, wypełniacze, antystatyki, antyutleniacze oraz inne substancje polepszające jakość polimerów. Tworzywa sztuczne są powszechnie stosowane w przemyśle budowniczym, transportowym, medycznym i gospodarstwa domowego. Na ryc. 1 przedstawiono procentowy udział poszczególnych sektorów światowej gospodarki, w których stosuję się tworzywa sztuczne.
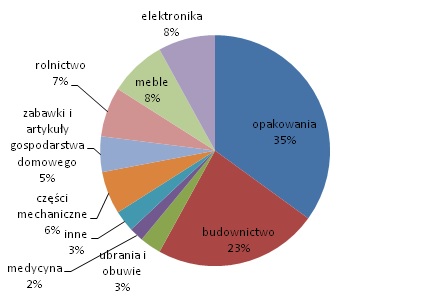
Ryc. 1. Zastosowanie tworzyw sztucznych na świecie w 2010 roku (opracowanie własne na podstawie [1])
Masową produkcję tworzywa sztucznego rozpoczęto się w latach 50 XX wieku. W ostatnich 60 latach wzrosła do 190 mln ton w 2000 roku oraz do 270 mln ton w 2010 roku.
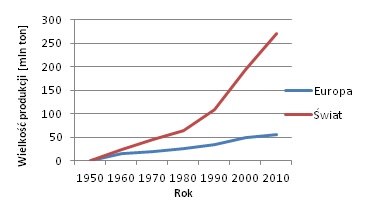
Ryc. 2. Produkcja tworzywa sztucznego na przestrzeni 60 lat (opracowanie własne na podstawie [1])
Przyczyny gwałtownego wzrostu produkcji są różnorodne. Jedną z nich jest niewielka cena produkcji, inną niska waga plastików, co znacząco obniża koszty transportu. Produkty z tworzywa sztucznego charakteryzują się ponadto różnymi właściwościami, takimi jak wysoka odporność na działanie czynników chemicznych i fizycznych oraz łatwość przetwórstwa i barwienia [2].
Na powierzchni mórz i oceanów unoszą się ogromne masy zanieczyszczeń z tworzyw polimerowych, których całkowitą ilość szacuję się na około 100 mln ton. Dryfujące fragmenty plastików stanowią duże niebezpieczeństwo dla roślin i zwierząt. Dodatkowo zauważono, że małe cząsteczki plastiku są obecne w przewodach pokarmowych ryb i ptaków morskich. Źródła zanieczyszczenia mórz i oceanów plastikami można podzielić na bezpośrednie i pośrednie. Do bezpośrednich zalicza się porty, przemysł żeglarski, stocznie, turystykę nadmorską oraz systemy rzeczne. Źródłami pośrednimi mogą być również oczyszczalnie ścieków i składowiska odpadów.
W niniejszym przeglądzie zdefiniowano zagrożenie środowiskowe wynikające z obecności mikroplastików w naturalnych zbiornikach wodnych. Scharakteryzowano ich pochodzenie, wpływ na florę i faunę oraz omówiono metodę pobierania i analizy próbek wody, osadów i organizmów morskich w celu ustalenia obecności mikroplastików.
Mikroplastiki
Mikroplastiki to małe cząsteczki tworzywa sztucznego o wielkości od kilku mikrometrów do 5 milimetrów [3]. Występują w różnych kształtach i kolorach oraz pochodzą z wielu rodzajów tworzyw. Najpopularniejsze z nich to polietylen (PE), polipropylen (PP), polichlorek winylu (PVC), polistyren (PS), poliuretan (PUR) oraz politereftalan etylenu (PET).
W celu ułatwienia identyfikacji tworzyw sztucznych przez konsumentów, stworzono międzynarodowy system kodyfikacji tworzyw. W tabeli 1 przedstawiono kody tworzyw sztucznych oraz ich charakterystykę.
Tab. 1. Międzynarodowy system kodyfikacji tworzywa sztucznego.
| Symbol | Pełna nazwa | Właściwości fizykochemiczne | Zastosowanie |
 |
Politereftalan etylenu |
|
|
 |
Polietylen dużej gęstości |
|
|
 |
Polietylen małej gęstości |
|
|
 |
Polichlorek winylu |
|
|
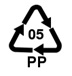 |
Polipropylen |
|
|
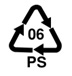 |
Polistyren |
|
|
Mikrometryczne cząsteczki tworzywa sztucznego można podzielić ze względu na pochodzenie. Wyróżnia się podział na pierwotne i wtórne [7]. Mikroplastiki pierwotne są produkowane w mikroskopijnych wielkościach. Stosuje się je powszechnie w kosmetykach, środkach czyszczących i złuszczających, gdzie zastąpiły dawniej stosowane produkty naturalne. Porowata powierzchnia ułatwia sorpcje innych substancji. Mikroplastiki należą do związków hydrofobowych, charakteryzujących się dużym powinowactwem do związków organicznych. W rezultacie cząsteczki mikroplastików gromadzą na swojej powierzchni wiele zanieczyszczeń. Gromadzone zanieczyszczenia bardzo często wykazują właściwości toksyczne i mutagenne, które negatywnie wpływają na organizmy mające z nimi kontakt. Toksyczność może także wynikać z rozpadu cząsteczek plastiku, kiedy dochodzi do uwolnienia substancji wykorzystywanych podczas produkcji. Mikroplastiki wtórne powstają z rozpadu większych elementów tworzywa poprzez działanie czynników fizycznych, biologicznych i chemicznych. Fragmentacja większych cząsteczek plastiku może zachodzić z udziałem promieniowania słonecznego, falowania wód, a także poprzez mechaniczne rozdrabnianie.
Pochodzenie i dystrybucja
Na początku XX wieku wody Bałtyku uważano za przejrzyście czyste. Obecnie Bałtyk jest jednym z najbardziej zanieczyszczonych mórz. Obszar jego zlewiska obejmuję dziewięć uprzemysłowionych państw, co przyczynia się do rosnącego zanieczyszczenia. Najwięcej odpadów trafiających do morza można zaobserwować w ujściach rzek takich jak Newa, Niemna, Wisła oraz Odra. Szacuję się, że około 10% obecnego dna morskiego dna to pozbawiona życia pustynia morska, która z upływem czasu będzie się powiększać [4].
Tworzywa sztuczne trafiają do środowiska wodnego ze źródeł lądowych lub bezpośrednio morskich. Obecność tworzyw sztucznych na powierzchni gruntu ułatwia ich migrację do systemów rzecznych, a tym samym spływ do mórz. W skali krajowej kilkaset ton plastików rocznie trafia bezpośrednio do rzek, jezior, strumieni czy też kanałów odpływowych skąd transportowane są dalej do zbiorników wody słonej. Istotnym źródłem mikroplastików w środowisku są także oczyszczalnie ścieków. Ze względu na to, że większość oczyszczalni obecnej konstrukcji nie zostaje dostosowana do wychwytu mikrocząsteczek plastiku, obecność środowiskowa tej grupy zanieczyszczeń tworzy poważny problem ekologiczny. Szacuje się, że co roku w skali światowej do oceanów trafia aż 10% produkcji plastiku, czyli około 30-40 mln ton [4].
Mikroplastiki dostają się do oczyszczalni ścieków z wielu źródeł. Jednym z nich są systemy domowej kanalizacji. Podczas jednego prania może zostać uwolnionych ponad 2000 włókien syntetycznych, które za pośrednictwem kanalizacji wodnej spływają do oczyszczalni. Tkaniny pochodzenia syntetycznego takie jak polar, poliester i akryl ocierają się o siebie w trakcie prania. Uwolnione mikroskopijne fragmenty włókien nie ulegają filtracji i dostają się do środowiska wodnego. Dodatkowo proszki oraz kapsułki piorące zawierają mikroplastiki w celu poprawy jakości prania tkanin.
Do kanalizacji miejskiej dostają się także kosmetyki i detergenty. Wiele kosmetyków złuszczających takich jak peelingi, pasty do zębów, żele myjące, kremy, a nawet szminki zawierają znaczące ilości mikrometrycznych cząsteczek plastiku. W kosmetyce wykorzystywane są głównie w celu ścierania martwego naskórka. Pełnią również funkcję matującą, zmętniającą oraz podnoszą walory estetyczne (brokat). Do detergentów zawierających mikroplastiki należą środki myjące oraz kapsułki do zmywarek. Pełnią w nich funkcję ścierną znacząco poprawiającą jakość oczyszczenia naczyń z resztek nieskonsumowanego pożywienia.
Kolejnym źródłem zanieczyszczenia środowiska wodnego mikroplastikami jest pył o charakterze butadienowo-styrenowym pochodzący z opon samochodów. Pył, który powstaje w trakcie jazdy ulega depozycji do podłoża, a następnie w trakcie opadu atmosferycznego spływa do studzienek kanalizacji i systemów odwadniających skąd pośrednio lub bezpośrednio trafia do powierzchniowych wód płynących i w efekcie do mórz i oceanów.
Kolejne potencjalne źródło stanowią farby, które zawierają syntetyczne polimery. Pył może powstawać z pomalowanych powierzchni dróg, statków czy domów.
Należy pamiętać, że do zanieczyszczenia środowiska plastikami najczęściej przyczyniają się ludzie poprzez zaśmiecanie środowiska tworzywami, które wyrzucają w niedozwolonych miejscach. Znacząca ilość odpadów o rozmiarach mikrometrycznych dostaje się do wód w okresie wakacyjnym. Na wielu nadmorskich plażach turyści celowo pozostawiają butelki, worki czy inne pojemniki pochodzenia sztucznego. Tworzywa sztuczne, które pozostają na plaży mogą trafiać bezpośrednio do morza w efekcie cyklicznego obmywania plaży falami o różnej intensywności i zasięgu.
Do istotnych sposobów zanieczyszczania mórz i oceanów zalicza się funkcjonowanie portów, stoczni i przemysłu żeglarskiego. W stoczniach i portach bardzo często dochodzi do bezpośredniego zanieczyszczenia wód ze względu na powszechne wyrzucanie toreb, siatek, pojemników i butelek bezpośrednio za burtę jednostek pływających. W stoczniach podczas budowy, rekonstrukcji lub naprawy statków również można spotkać przypadki niedostatecznej segregacji odpadów, w rezultacie czego plastikowe części trafiają do wód. Negatywnymi skutkami oddziaływania przemysłu żeglarskiego i rekreacji wędkarskiej na środowisko wodne jest pozostawianie w zbiornikach wodnych lin, żagli, elementów kadłubów, a także sieci rybackich, żyłek i spławików.
Wpływ na ekosystem wodny
Elementy tworzyw polimerowych obecnych w naturalnych zbiornikach wodnych rozpadają się na coraz mniejsze fragmenty pod wpływem ruchów fal i światła słonecznego. Szacuję się, że około 60% plastiku znajdującego się w zbiornikach wodnych ma mniej niż 1 milimetr średnicy. Cząsteczki mikroplastiku unoszą się w toni wodnej od powierzchni wody aż do 15 metrów w głąb zbiornika. Zanieczyszczenia cząsteczkami tworzywa sztucznego mogą ważyć miliony ton, a tym samym ograniczyć wymianę gazową organizmów wodnych i zakłócać ogólne funkcjonowanie ekosystemu [5].
Zbadano wpływ zanieczyszczenia tworzywem sztucznym na życie zwierząt. Szacuję się, iż około 300 gatunków jest zagrożonych, ponieważ niestrawione resztki plastiku blokują układ pokarmowy, a w licznych przypadkach doprowadzają do ich śmierci. Oszacowano, że rocznie ginie z tego powodu ok. 100 tysięcy ssaków morskich i około milion ptaków. Równorzędne zagrożenie dotyczy także żółwi i wydr morskich, które zaplątują się w nylonowe sieci [6]. Wykazano, iż spożycie mikroplastików mniejszych niż 1,4 mm przez słodkowodne skorupiaki (Daphnia magna) powoduję wzrost śmiertelności nawet po 48 godzinach [7].
Mikroplastiki oznaczono w zooplanktonie, małżach, rybach i ptakach. Cząsteczki tworzywa sztucznego o niskiej gęstości unoszą się przy powierzchni wody. W tej strefie są dostępne, a zarazem niebezpieczne dla żyjących w niej zooplanktonu i małych ryb. Cząsteczki o dużej gęstości opadają na dno, gdzie zostają kumulowane. W osadach dennych zostają wchłaniane przez organizmy na skutek mylenia ich z naturalnym pokarmem. Mikroplastiki obecne w przewodach pokarmowych organizmów wodnych zostają przenoszone w łańcuchu pokarmowym, a w rezultacie mogą trafić do przewodu pokarmowego człowieka. Na rysunku 3 przedstawiono schemat transportu cząstek mikroplastików w łańcuchu pokarmowym w przykładowym słonowodnym zbiorniku wodnym.
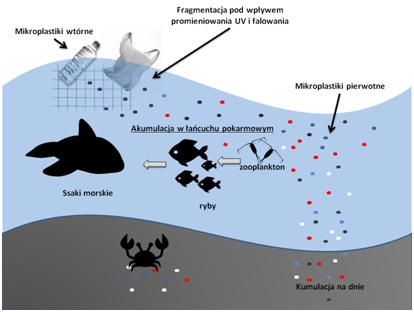
Ryc. 3. Transport cząsteczek mikroplastików w łańcuchu pokarmowym w środowisku wodnym
Tworzywa sztuczne otrzymuję się w wyniku połączenia polimerów ze związkami pomocniczymi takimi jak wypełniacze, stabilizatory, plastyfikatory, barwniki, pigmenty, antystatyki, antyutleniacze, środki zmniejszające palność i inne, które ulepszają właściwości polimerów. W rezultacie mogą mieć toksyczny wpływ na organizmy ze względu na ryzyko połknięcia, wdychania bądź kontaktu skórnego. Tworzywa mogą zawierać środki zmiękczające, np. ftalany. Użycie tej zmiękczającej substancji do produkcji zabawek z polichlorku winylu zostało zakazane w Unii Europejskiej, z powodu negatywnego wpływu na zdrowie [8]. Mikroplastiki obecne w zbiornikach wodnych absorbują i transportują wiele substancji toksycznych takich jak pestycydy, detergenty czy polichlorowane bifenyle. Substancje szkodliwe mogą pochodzić z oczyszczalni ścieków, okolic składowiska odpadów i kanalizacji miejskiej.
Metody pobierania i analizy próbek
Pobieranie próbek
W środowisku wodnym można pobierać kilka rodzajów próbek. Należą do nich woda, osad oraz organizmy wodne, a szczególnie ich układ pokarmowy. Próbki mogą być selektywne, całkowite lub o zmniejszonej ilości.
Selektywne pobieranie próbek polega na pobieraniu materiału, na powierzchni którego wizualnie można rozpoznać szukany mikroplastik. Metodę tą można zastosować, kiedy chcemy jedynie potwierdzić obecność tworzywa sztucznego w pobieranym materiale. Dodatkowo należy zaznaczyć, że tą metodą można dostrzec cząsteczki mikroplastiku o średnicy od 1 do 6 mm. Mniejsze cząsteczki oraz takie, które posiadają nieregularny kształt oraz porowatą powierzchnię, do której jest absorbowana materia organiczna mogą pozostać niezauważone.
Próbki całkowite pobiera się w sytuacji, kiedy wizualnie nie można zidentyfikować obecności mikroplastiku w pobieranym materiale. Zdarza się bowiem, że cząsteczki mikroplastików pokrywają się drobinami osadu lub materii organicznej co utrudnia identyfikację.
Ostatni rodzaj próbki odnosi się do sytuacji, w których objętość pobranego materiału jest zmniejszana. Zachowuję się jedynie część, która jest przedmiotem zainteresowania. Daną metodę stosuję się do pobierania próbek wody, gdzie dodatkowo używa się sieci filtrujących, w celu wydobycia mikroplastików.
Próbki osadów
Próbki osadu mogą być pobierane na plaży, linii brzegowej plaży oraz z dna zbiornika wodnego. Wykazano, że mikroplastiki gromadzą się w każdej strefie plaży, zwykle w pobliżu linii brzegowej i w górnych strefach plaży [9]. Rozmieszczenie cząsteczek tworzywa sztucznego w strefie dennej morza jest uwarunkowane kierunkiem oraz siłą prądów, wiatrów, a także aktywnością zwierząt.
Próbki piasku z plaży należy pobierać za pomocą specjalnego próbnika, który jest zbudowany z metalowej rury i uchwytu przymocowanym w górnej części. Lance pobierczą wkłada się pod kątem prostym do wymaganej głębokości w powierzchnię piasku, otworem pobierczym skierowanym w dół. Po osiągnięciu wymaganej głębokości próbnik należy obróć o 180 stopni otworem skierowanym ku górze. Następnie metalową szpatułką należy pobrać próbki piasku przez otwory wlotowe z różnych głębokości. Ustalono, że drobiny mikroplastików mogą znajdować się nawet do 60 cm poniżej powierzchni plaży [10].
Do pobrania próbek osadu z dna zbiornika wodnego używa się próbnika osadów dennych typu Beeker’a. Dzięki niemu można pobierać próbki nawet z głębokości kilkunastu metrów. Próbnik zbudowany jest z rury, do której pobierany jest potrzebny osad oraz liny, na której rura zostaje opuszczana i wciągana. Próbki zostają pobierane poprzez wbicie rury w dno zbiornika wodnego. Na dolnej części rury znajduję się głowica tnąca, która zabezpiecza pobrane próbki. Szczelnie zamkniętą w rurze próbkę wyciąga się za pomocą liny przymocowanej do górnej części próbnika. Po wyciągnięciu próbnika z wody próbki przenosi się do szczelnych i czystych pojemników. Na rycinie 4 przedstawiono przykładowe zdjęcia próbników do pobierania piasku z plaży oraz próbnik typu Beeker’a do pobierania osadów dennych.
|
|
|
Ryc. 4. Przykładowe zdjęcia próbników: 1- próbnik do pobierania piasku z plaży, 2- próbnik typu Beeker’a do pobierania osadów dennych.
Próbki wody
Próbki wody należy pobierać z kilku głębokości, a także z powierzchni wody. Materiał dryfujący w wodzie można pobierać za pomocą sieci neustonowych. Główną zaletą korzystania z sieci jest szybkie filtrowanie dużej objętości wody, zachowując jedynie materiał potrzebny do badań. Stosuje się sieci o różnych średnicach oczek: od 0,053 mm do 3 mm [11]. Na rycinie 5 przedstawiono przykładową fotografię sieci neustonowych.

Ryc. 5. Sieć neustonowa
Organizmy morskie
Do najczęściej badanych organizmów morskich zalicza się ryby. Żołądki ryb złowionych w badanych zbiornikach wodnych należy wyciąć w dniu złowienia. Żołądki przechowuję się w 37% roztworze formaldehydu rozcieńczonego wodą morską w stosunku 1:6. Następnie w laboratorium należy wyekstrahować zawartość żołądków za pomocą nożyczek i kleszczy, a następnie wprowadzić do roztworu formaldehydu. W kolejnym etapie rozwór przesącza się przez filtry membranowe o porowatości 5 µm. Filtry muszą zostać przepłukane 9% roztworem podchlorynu sodu. Przefiltrowane zawartości żołądka należy pozostawić w roztworze NaClO na okres 15 godzin w celu strawienia resztek materii organicznej. Po strawieniu próbkę przesącza się przez kolejny filtr, a membranę filtru przepłukuje 65% roztworem kwasu azotowego i rozcieńczonym roztworem podchlorynu sodu w stosunku 1:10. W kolejnym etapie membranę wprowadza się do etanolu i poddaje działaniu ultradźwięków o częstotliwości 50 Hz za pomocą łaźni ultradźwiękowej przez 5 minut. Działanie ultradźwiękami usuwa cząsteczki z membrany. Następnie membranę należy usunąć z roztworu, a metanol odwirować. Po odlaniu supernatantu osad odparowuje się. Po odparowaniu cząsteczki mikroplastiku są gotowe do analizy [12].
Przygotowywanie próbek
Wyróżnia się cztery główne etapy obróbki laboratoryjnej pobranych próbek osadu i wody:
- separacja ze względu na gęstość,
- filtracja,
- przesiewanie,
- ocena wizualna.
Na ryc. 6 przedstawiono schemat przygotowania pobranego materiału do badań.
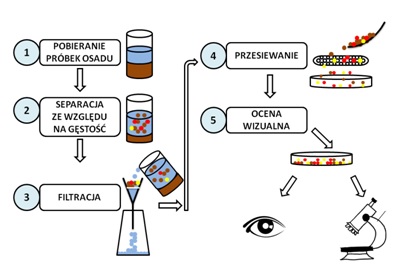
Ryc. 6. Przygotowanie pobranego osadu do badań
Separacja ze względu na gęstość
Gęstość właściwa cząsteczki tworzywa sztucznego może mieć zakres od 0,8 do 2,4 g/cm3 w zależności od polimeru bądź procesu produkcyjnego tworzywa. W tabeli 2 przedstawiono gęstość polimerów tworzywa sztucznego.
Tab. 2. Gęstość polimerów tworzywa sztucznego.
|
typ polimeru |
gęstość polimeru (g/cm3) |
|
polietylen |
0,92-0,97 |
|
polipropylen |
0,90-0,91 |
|
polistyren |
1,04-1,00 |
|
poliamid (nylon) |
1,02-1,05 |
|
poliester |
1,24-2,30 |
|
akryl |
1,09-1,20 |
|
polioksymetylen |
1,41-1,61 |
|
alkohol poliwinylowy |
1,19-1,31 |
|
polichlorek winylu |
1,16-1,58 |
|
polimetakrylan metylu |
1,17-1,20 |
|
tereftalan polietylenu |
1,37-1,45 |
|
alkid |
1,24-2,10 |
|
poliuretan |
1,2 |
Uwzględniając typową gęstość piasku wynoszącą ok. 2,65 g/cm3 różnicę ciężaru wykorzystuję się do oddzielenia lżejszych cząsteczek tworzywa sztucznego od cięższych cząsteczek piasku. Jest to możliwe poprzez zmieszanie próbki z odpowiednim roztworem nasyconym i mieszanie przez kilka minut. W nasyconym roztworze soli NaCl unoszą się cząsteczki o gęstości mniejszej od 1,2 g/cm3, w poliwęglanie sodu – 1,4 g/cm3 zaś w roztworze wodorotlenku sodu unoszą się cząsteczki tworzywa sztucznego zbudowane z polichlorku winylu, polietylenu tereflanu oraz nylonu. Po wymieszaniu należy odstawić próbkę na kilka minut by cięższe cząsteczki opadły, a lżejsze pozostały w zawiesinie lub na powierzchni roztworu. Następnie supernatant wraz z cząsteczkami tworzywa sztucznego ekstrahuję się w celu dalszej obróbki. W celu rozdzielenia cząsteczek tworzywa sztucznego, które charakteryzują się innymi wartościami gęstości wykorzystuję się różne mieszaniny.
Filtracja
Cząsteczki tworzywa sztucznego zostają oddzielone od supernatantu za pomocą filtrów, zwykle wspomaganych pompą próżniową. Pory w papierkach filtracyjnych mają rozmiar od 1 do 6 μm. W celu uporządkowania większych cząsteczek przed ostateczną filtracją można przesączyć próbki przez filtry o porowatości 500 μm. Zaleca się przepłukanie naczynia wodą destylowaną, z którego został wylany supernatant, ponieważ cząsteczki mikroplastiku mogą zostać przyklejone do ścian naczynia.
Przesiewanie
Mikroplastiki o różnej wielkości można rozdzielać od siebie stosując sita o różnych rozmiarach oczek. Materiał zatrzymany na sicie zbiera się i sortuję, natomiast pozostały przesiewa się przez mniejsze sita. W badaniach stosuję się sita o rozmiarach oczek od 0,038 do 4,75 mm.
Ocena wizualna
Pierwszym etapem jest oddzielenie tworzywa od zanieczyszczeń organicznych takich jak fragmenty muszli, części zwierząt, glony oraz trawy, a także od innych przedmiotów, np. szkła i metalowych elementów. Można to wykonać bezpośrednio poprzez wizualne badanie próbki lub za pomocą mikroskopu dyspersyjnego. Wyizolowane mikrocząsteczki tworzywa sztucznego można oddzielić od materii organicznej płucząc wodą dejonizowaną. Tworzywa oddzielone od próbki powinny być przechowywane w suchych warunkach o stabilnej temperaturze zapobiegających degradacji. Aby uniknąć błędnej identyfikacji mikroplastików należy ujednolicić kryteria ich oceny. W tabeli 3 przedstawiono kategorie charakterystyki mikroplastiku.
Tab. 3. Kategorie wizualnej charakterystyki mikroplastików [2].
|
źródło |
fragmenty produktów konsumenckich, mikroplastik pierwotny (granulki) |
|
rodzaj |
fragmenty plastiku, granulki, włókna, folie, styropian, |
|
kształt |
granulki: cylindryczne, dyskowate, płaskie, owalne, fragmenty: zaokrąglone, kanciaste |
|
ogólne |
nieregularne, wydłużone, zdegradowane, szorstkie, złamane krawędzie |
|
poziom zniszczenia |
brak, nieuporządkowane, wstępne zmiany, złamania, wyblakły, rowki, nieregularna powierzchnia, poszarpane fragmenty, bardzo zniszczone |
|
kolor |
przejrzysty, krystaliczny, biały, jasny, kremowo-biały, czerwony, pomarańczowy, niebieski, nieprzezroczysty, czarny, szary, brązowy, żółty, zielony, różowy |
Identyfikacja składu chemicznego mikroplastików
Do identyfikacji składu chemicznego mikroplastików można zastosować metody spektroskopowe w podczerwieni. Cząsteczki chemiczne, z których są zbudowane polimery znajdują się w określonym stanie energii rotacyjnej, oscylacyjnej i elektronowej. Po przejściu promieniowania przez analizowane cząsteczki polimeru następuję emisja i absorpcja określonych kwantów energii, która wynika z przejścia cząsteczki z jednego stanu kwantowego w drugi. Ilość pochłoniętej części promieniowania jest charakterystyczna dla cząsteczek, które wchodzą w skład badanego materiału. Wykorzystując tę zależność można zidentyfikować związki chemiczne przy udziale ich widm w podczerwieni. Identyfikacji można dokonać porównując analizowane widma z widmem znanego związku i stwierdzenie ich zgodności, bądź identyfikacji grup funkcyjnych. Za pomocą tej techniki można zidentyfikować szereg najpopularniejszych polimerów PP, PE i poliester [4]. Inną metodą analizy chemicznej mikroplastików jest spektroskopia Ramana, która informuję o strukturze chemicznej polimerów.
Podsumowanie
Na przestrzeni 60 lat poziom zanieczyszczenia środowiska plastikami wzrósł stukrotnie. Ważne jest, aby podjąć działania zmierzające do znacznego ograniczenia i używania produkcji tworzyw polimerowych oraz masowego wykorzystania tych odpadów. Systematyczny napływ owych zanieczyszczeń do naturalnych zbiorników wodnych zagraża roślinom, zwierzętom i ludziom. Powoduję nieodwracalne i niebezpieczne zmiany w środowisku morskim. Mikrometryczne elementy tworzywa sztucznego trafiają do łańcuchów pokarmowych organizmów wodnych. Dodatkowo poprzez dodatki uszlachetniające tworzywo sztuczne stają się toksyczne. Większość mikroplastycznych odpadów ma mikroskopijne rozmiary co utrudnia metodologię próbkowania i liczenia cząstek. Oznacza to, że w środowisku jest ogromna ilość niezidentyfikowanych zanieczyszczeń, które mają negatywny wpływ na życie biologiczne. Jego wpływ na zwierzęta i ludzi nie jest całkowicie poznany. Dlatego też badania dotyczące oznaczenia mikroplastików w środowisku, składu chemicznego oraz wpływu na organizmy należą do najbardziej aktualnych i porządanych.
Literatura
[1] Raport Europejskich Producentów tworzyw sztucznych i ich partnerów PlasticEurope, Analiza produkcji, zapotrzebowania oraz odzysku tworzyw sztucznych w Europie w roku 2010, Tworzywa sztuczne-fakty, 20, 2010.
[2] Hidalgo-Ruz V., Gutow L., Thompson R., Thiel M., Microplastic in the Marine environment: a review of the methods used for indetification and qualification, Environmental Science and Technology, 46, 3060-3075, 2012.
[3] Richard C., Thompson, Microplastics in the Marine Environment: Sources, Consequences and Solutions, Marine Anthropogenic Litter, 185-200, 2015.
[4] Browne M.A., Crump P., Niven S.J., Teuten E., Tonkin A., Galloway T., Thompson R., Accumulation of microplastic on shorelines worldwide: sources and sinks, Environmental Science and Technology, 21, 9175-9179, 2011.
[5] Cole M., Lindeque P., Holsband C., Galloway T.S., Microplastic as contaminants in the marine environment: a review, Marine Pollution Bulletin, 12, 2588-2597, 2011.
[6] Carson H.S., Nerheim M.S., Carroll K.A., Eriksen M., The plastic associated microorganism of the North Pacific Gyre, Marine Pollution Bulletin 75(1-2), 126-132, 2013.
[7] Jemec A., Horvat P., Kunej U., Bele M., Krzan A., Uptake and effects of microplastic fibers on freshwater crustacean Daphnia magna, Environmental Pollution, 219, 201-209, 2016.
[8] Stanisławska A., Śmieci biorą i dają życie, Gazeta Wyborcza, 12, 2013.
[9] Velander K., Mocogni M., Beach litter sampling strategies: is there a „best” method? Marine Pollution Bulletin, 38, 1134-1140, 1999.
[10] Martins J., Sobral P., Plastic marine debris on the Portuguese coastline: A matter of size? Marine Pollution Bulletin, 62, 2649-2653, 2011.
[11] Van Dolah R.F., Burrel V.G., West S.B., The distribution of pelagic tar and plastics in the South Atlantic Bight, Marine Pollution Bulletin, 11, 352-356, 1980.
[12] Stojicic S., Zivkovic S., Qian W., Tissue dissolution by sodium hypochlorite: effect of concentration, temperature, agitation and surfaktant, Journal of Endodontics, 36, 1558-1562, 2010.
[25] Vlietstra, L. S., Parga, J.A., Long-term changes in the type, but not amount, of ingested plastic particles in short-tailed shearwaters in the southeastern Bering Sea. Marine Pollution Bulletin, 44, 945−955, 2002.
*Akademia Pomorska, Zakład Chemii Środowiskowej,
Instytut Biologii i Ochrony Środowiska, ul. Arciszewskiego 22b, 76-200 Słupsk,
tel. (59) 8405-423, fax (59) 8405-423, e-mail: paulina.piskula@apsl.edu.pl


