Mikroskopia konfokalna SIL
Autor: B. Krajnik, D. Piątkowski, S. Maćkowski*, M. Gagoś**, E. Tomaszewska, J. Grobelny***
Wprowadzenie
Wykorzystanie światła jako narzędzia do badania mikroświata pozwala uzyskać informacje o jego budowie i naturze zjawisk w nim zachodzących. Pomimo nieustannego rozwoju technologii nie jest możliwe pokonanie ograniczeń wynikających z falowej natury światła. Jej konsekwencją jest limit dyfrakcyjny, który ilościowo opisuje kryterium Rayleigha. Wyznacza ono minimalną odległość pomiędzy punktowymi źródłami światła rozróżnialnymi przez układ optyczny. Chociaż przyrody nie można oszukać, istnieje kilka sposobów pozwalających na przesuniecie limitu dyfrakcyjnego. Najczęściej stosowaną metodą jest zastosowanie oleju imersyjnego, którym wypełnia się przestrzeń pomiędzy obiektywem i próbką. Technika ta ma jednak kilka ograniczeń. Nie można jej stosować w przypadku próbek wrażliwych na kontakt z olejem imersyjnym. Ponadto staje się ona bezużyteczna przy pomiarach w niskich, kriogenicznych, temperaturach.
Technika szklanej soczewki imersyjnej SIL (solid immersion lens) została wprowadzona przez Mansfielda i Kino [1] w celu poprawienia gęstości zapisu informacji na dyskach optycznych. Wkrótce zaczęto ją powszechnie stosować w układach wymagających dużej rozdzielczości przestrzennej m. in. w litografii oraz w badaniach studni [2] i kropek kwantowych [3-5]. Soczewka imersyjna jest wolną od aberracji, szklaną półsferą, wykonaną ze szkła o wysokim współczynniku załamania, znacznie przewyższającym typowe wartości współczynników załamania olejów imersyjnych. Krzywizna soczewki dodatkowo zmienia właściwości optyczne układu umożliwiając uzyskanie mniejszej plamki lasera, a także silniejsze powiększenia. Poza zwiększeniem rozdzielczości wykorzystanie soczewki imersyjnej pozwala na znaczne zwiększenie ilości światła fluorescencji transmitowanego w kierunku kanału detekcyjnego. Wszystkie te cechy czynią SIL doskonałym narzędziem do pomiarów, gdzie niezbędna jest duża rozdzielczość i wysoka czułość np. przy badaniu nanostruktur lub fluorescencji z pojedynczych molekuł. W dalszej części pracy zaprezentujemy możliwości mikroskopu SIL na przykładzie pomiarów fluorescencji z pojedynczej monowarstwy.
Materiały i metody
Przedmiotem naszych badań jest białko fotosyntetyczne PCP (peridinin-chlorophyll-protein) występujące w środowisku naturalnym w algach. Pełni ono rolę anteny przekazującej energię wzbudzenia do centrum reakcyjnego. Struktura PCP (Rys. 1a) została bardzo dobrze zbadana za pomocą metod dyfraktometrii rentgenowskiej [6]. Pojedynczy monomer PCP tworzony jest przez cztery perydininy, jeden chlorofil i jedną cząsteczkę lipidu. Perydinina jest głównym absorberem, odpowiedzialnym za absorpcję w zakresie 350-550 nm. Chlorofil absorbuje ok. 668 nm (pasmo Qy) i 440 nm (pasmo Soret). Fluorescencja PCP (Rys. 1c) pochodzi od przejścia Qy chlorofilu z emisją światła o długości fali 673 nm. Ze względu na dużą różnicę pomiędzy pasmem absorpcji perydininy i emisji chlorofilu, oraz możliwość modyfikacji struktury pigmentów wchodzących w skład kompleksu PCP, jest on doskonałym systemem do badania oddziaływania pomiędzy plazmonami i biomolekułami [8, 9].
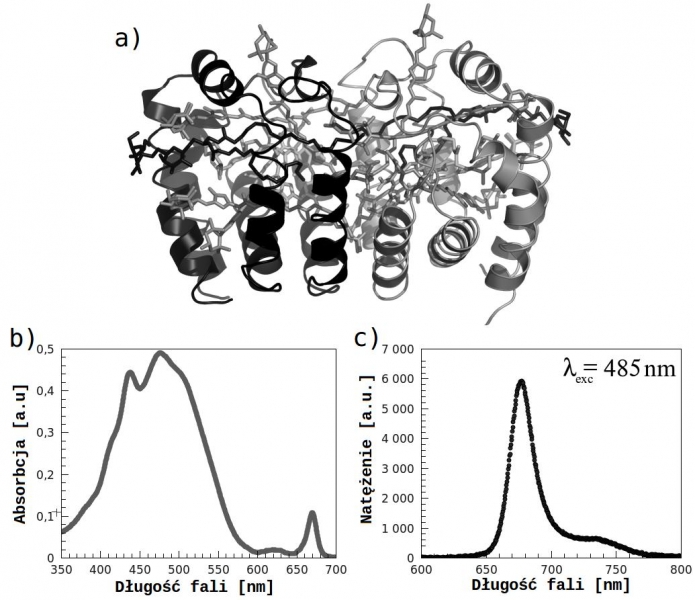
Rys. 1. a) Struktura PCP (RFPCP): dwa chlorofile, osiem perydinin, dwie reszty lipidowe. b) Widmo absorpcji i c) emisji PCP
Na rys. 2a przedstawiamy schemat mikroskopu konfokalnego SIL opartego na obiektywie LMPlan 50x firmy Olympus o aperturze numerycznej 0.5 i zakresie roboczym 6 mm, umożliwiającym skupienie lasera o długości fali 485 nm do plamki o średnicy ok. 1 μm. W celu poprawy rozdzielczości układu zastosowaliśmy soczewkę imersyjną o średnicy 3 mm, wykonaną ze szkła S-LAH-71 o współczynniku załamania 1,85. Ułożenie soczewki na próbce przedstawia rys. 2b Soczewka jest dociśnięta do próbki w celu usunięcia powietrza z przestrzeni pomiędzy soczewką i próbką. Całość znajduje się na stoliku piezoelektrycznym XYZ (Physik Instrumente) o precyzji przesuwu 1 nm. Stolik umożliwia nam otrzymywanie map natężenia fluorescencji poprzez rastrowe przesuwanie powierzchni próbki w płaszczyźnie XY przy jednoczesnym pomiarze natężenia fluorescencji. Fluorescencja jest wzbudzana za pomocą lasera półprzewodnikowego o długości fali 485 nm. Światło fluorescencji jest ogniskowane na przesłonie konfokalnej o średnicy 75 μm, definiującej płaszczyznę ogniska z której zbierana jest fluorescencja. Emisja z próbki PCP jest filtrowana za pomocą zwierciadła dichroicznego HQ 650LP (Chroma) oraz filtra pasmowego HQ 670/10 (Chroma).
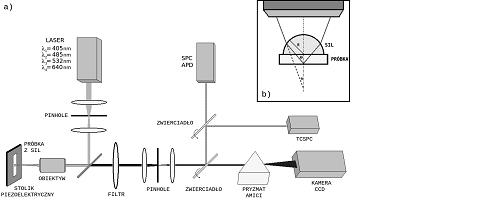
Rys. 2. a) Schemat układu doświadczalnego do pomiarów spektroskopowych z wykorzystaniem SIL. b) Idea działania soczewki imersyjnej
Mikroskop SIL daje możliwość pomiarów natężenia fluorescencji, czasów życia oraz widm emisji. Światło wyemitowane z próbki jest rozszczepiane za pomocą pryzmatu Amici i kierowane na kamerę CCD (Andor iDus DV 420A-BV), która umożliwia pomiary z rozdzielczością około 2 nm. Do tworzenia mapy natężenia fluorescencji wykorzystujemy fotodiodę lawinową (PerkinElmer SPCM-AQRH-14) z prądem ciemnym na poziomie 80 zliczeń na sekundę.
Do naniesienia pojedynczej monowarstwy na stałe podłoże za pomocą techniki Langmuira-Blodgett wykorzystaliśmy system Minitrough (KSV NIMA). PCP zostało dodane do wodnego roztworu nanocząstek srebra o średnicy 40 nm w jednakowym stosunku wagowym. Tak przygotowany roztwór nanieśliśmy na subfazę, wodę Milli-Q (Fluka), na którą uprzednio nanieśliśmy 2% wodny roztwór PVA, w celu ułatwienia białku i nanocząstkom pozostania na powierzchni. Procedurę powtórzyliśmy dla roztworu PCP pozbawionego nanocząstek srebra.
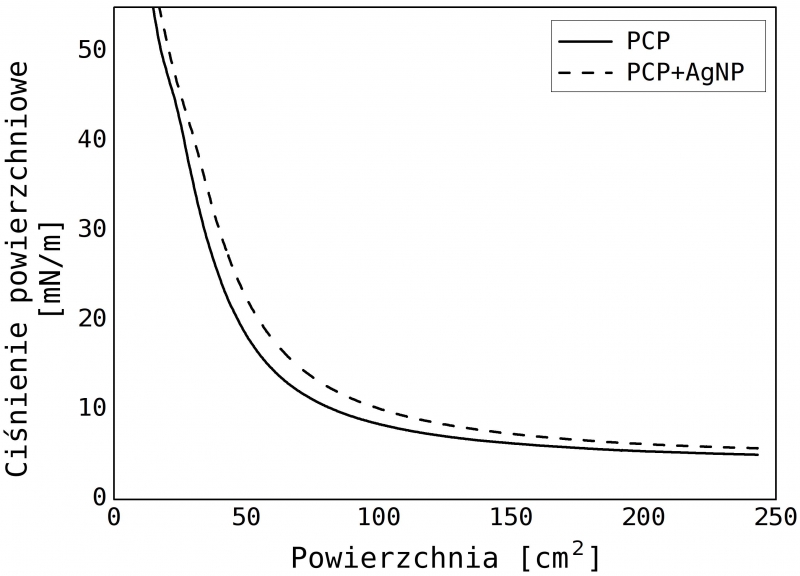
Rys. 3. Izotermy uzyskane w wyniku sprężania monowarstw PCP oraz PCP ze srebrnymi nanocząstkami. Na osi rzędnych zaprezentowano zmianę powierzchni zajmowanej przez monowarstwę podczas sprężania
Część eksperymentalna
W celu sprawdzenia poziomu samoorganizacji cząsteczek na powierzchni subfazy, zmierzyliśmy izotermy dla nanoszonych substancji. W obu przypadkach uzyskaliśmy podobny kształt izoterm o regularnym hiperbolicznym kształcie, co potwierdza prawidłowy przebieg procesu samoorganizacji molekuł na powierzchni. Pomimo dużego ciśnienia powierzchniowego ok. 55 mN/m2 nie doszło do kolapsu. Dla obu prezentowanych próbek, monowarstwę nanosiliśmy na uprzednio oczyszczoną mikę, przy napięciu powierzchniowym 25 mN/m2. Tak przygotowane próbki umieściliśmy w mikroskopie konfokalnym i wykonaliśmy pomiar natężenia fluorescencji w funkcji położenia stolika, z krokiem 500 nm. Zobrazowaliśmy obszar o wymiarze 40 μm x 40 μm, wykorzystując laser 485 nm o mocy wiązki 8 μW. Czas integracji fotodiody wynosił 0,1 s. Wynik w postaci map natężenia fluorescencji przedstawiają rysunki 4a i 4b. W celu zweryfikowania źródła fluorescencji zmierzono widmo emisji z rożnych obszarów próbki. Otrzymane widma (rys. 4d) charakteryzowały się silną emisją 670 nm, charakterystyczną dla kompleksu PCP. Duża jednorodność map wskazuje na wysoki współczynnik przenoszenia ok. 90%, co potwierdza efektywność zastosowanej metody. Ponad dwukrotny spadek średniej intensywności fluorescencji dla próbki PCP z nanocząstkami srebra, widoczny na histogramach (rys. 4c) pozwala przypuszczać, że obecność nanocząstek w bezpośrednim sąsiedztwie molekuł PCP gasi fluorescencję.
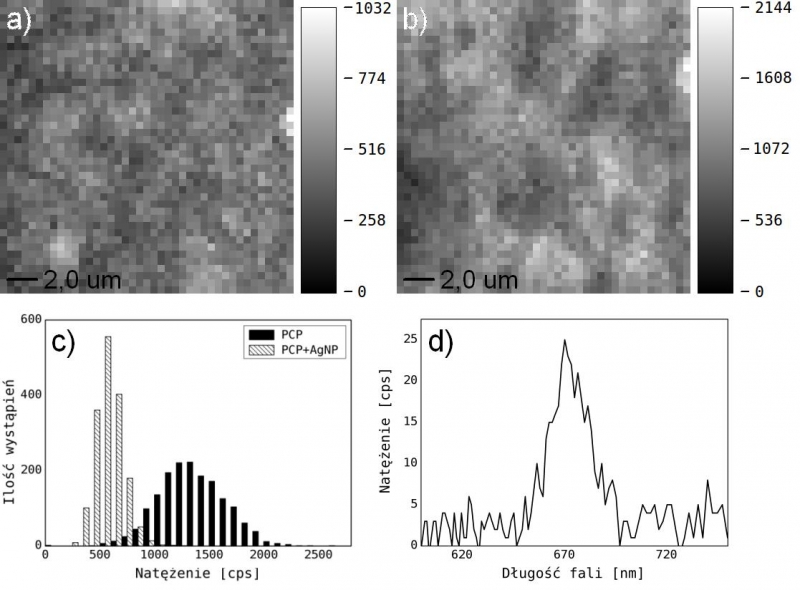
Rys. 4. a) Mapa natężenia fluorescencji próbki PCP ze srebrnymi nanokulkami; b) Mapa natężenia fluorescencji uzyskana dla próbki PCP pozbawionej nanocząstek, c) Porównanie histogramów intensywności obu map, d) Przykładowe widmo emisji PCP z monowarstwy.
Wnioski
Układ oparty o mikroskop SIL umożliwia pomiary spektroskopowe słabo świecących obiektów z wykorzystaniem szklanej soczewki imersyjnej. Wykonaliśmy pomiary natężenia fluorescencji z pojedynczej monowarstwy białka fotosyntetycznego PCP w obecności srebrnych nanocząstek. Znaczny spadek fluorescencji spowodowany jest najprawdopodobniej efektem gaszenia fluorescencji przez metaliczne nanocząstki położone blisko emiterów.
Podziękowanie
Praca powstała przy wsparciu projektu „Hybrid nanostructures as a stepping stone towards efficient artificial photosynthesis” finansowanego przez Fundację na rzecz Nauki Polskiej w ramach programu WELCOME.
Literatura
1. S. M. Mansfield and G. S. Kino, Appl. Phys. Lett., 57 (1990), 2615.
2. Q. Wu, G.D. Feke, R.D. Grober, L.P. Ghislain, Appl. Phys. Lett., 75 (1999), 4064.
3. S. Moehl, H. Zhao, B. Dal Don, S. Wachter, H. Kalt, J. Appl. Phys. 93 (2003), 6265.
4. M. Baba, T. Sasaki, M. Yoshita, H. Akiyama, J. Appl. Phys., 85 (1999), 6923.
5. K.P. Hewaparakrama et al., Appl. Phys. Lett., 85 (2004), 5463.
6. E. Hofmann, et al., Science, 272 (1996), 1788.
7. D.J. Miller et al., Photosynth. Res., 86 (2005), 229.
8. S. Mackowski et al., Nano Lett., 8 (2008), 558; S. Mackowski, J. Phys. Condens. Matter, 22 (2010), 193102
9. B. Krajnik et al. Centr. Eur. J. Phys. 9 (2011) 293.
Temat był przedstawiony na sympozjum Nauka i przemysł. Metody spektroskopowe w praktyce – nowe wyzwania i możliwości w Lublinie (2011)
*B. Krajnik, D. Piątkowski, S. Maćkowski, UMK, Wydział Fizyki Astronomii i Informatyki Stosowanej, Instytut Fizyki, Zespół Optyki Nanostruktur Hybrydowych, ul. Grudziądzka 5, 87-100 Toruń, email: bakrag@fizyka.umk.pl(link sends e-mail)
**M. Gagoś, UP, Katedra Fizyki, Zakład Biofizyki, ul. Akademicka 13, 20-950 Lublin
***E. Tomaszewska, J. Grobelny, UŁ, Wydział Chemii, Katedra Technologii i Chemii Materiałów, ul. Pomorska 163, 90-236 Łódź
