Zastosowanie LC/QTOF w badaniach pozostałości leków weterynaryjnych
Autor: E. Fornal¹, I. Varenina², D. Božić², B. Solomun Kolanović², I. Varga²
Analiza pozostałości leków weterynaryjnych w żywności ze względu na szeroka gamę leków dopuszczonych do stosowania, duże zróżnicowanie strukturalne związków, niskie stężenia analitów w bardzo złożonych matrycach stanowi nadal duże wyzwanie analityczne. Do przesiewowych analiz żywności na obecność pozostałości leków weterynaryjnych wskazane jest stosowanie selektywnych i czułych technik analitycznych. W niniejszej pracy przedstawiono wyniki badań nad możliwością wykorzystania chromatografii cieczowej sprzężonej z wysokorozdzielczą spektrometrią mas (LC-HRMS) do analizy pozostałości leków weterynaryjnych w tkankach mięśniowych.
W celu zapobiegania chorobom lub w celu leczenia zwierzętom przeznaczonym do produkcji żywności mogą być podawane leki weterynaryjne. W efekcie substancje te mogą być obecne w żywności jako pozostałości, gdy żywność pochodzi od leczonych zwierząt. Ponadto leki weterynaryjne mogą trafić do żywności na skutek niewłaściwych praktyk takich jak na przykład podawanie promotorów wzrostu w celu zwiększenia przyrostu masy zwierząt, czy w wyniku przypadkowo zanieczyszczenia. Poziom pozostałości leków weterynaryjnych w żywności nie powinien być szkodliwy dla konsumenta. Maksymalne dopuszczalne poziomy pozostałości regulują przepisy europejskie i krajowe. Limity te są różne dla różnych leków oraz produktów, wahają się od kilkunastu nanogramów na kilogram do kilkuset mikrogramów na kilogram. W przypadku substancji nie dozwolonych do stosowania u zwierząt przeznaczonych do produkcji żywności limit detekcji metody powinien być możliwie najniższy, aby zapewnić ochronę zdrowia konsumentów.
Do analizy przesiewowej żywności na obecność pozostałości leków weterynaryjnych niezbędne jest stosownie bardzo czułych i selektywnych technik analitycznych, które umożliwiają pewną ich identyfikację w bardzo złożonych matrycach. Co raz częściej do tego celu wykorzystuje się chromatografię cieczową sprzężoną z wysoko rozdzielczą spektrometrią mas (LC-HRMS) [1-7]. Zapewnia ona niezbędną selektywność i czułość oznaczenia. Do identyfikacji pozostałości wykorzystuje się zarówno analizatory mas typu kwadrupol sprzężony z analizatorem czasu przelotu (Q/TOF) jonów jak i orbitrap.
Celem przedstawionych w pracy badań była ocena możliwości wykorzystania LC-Q/TOF do wykrywania i identyfikacji pozostałości leków weterynaryjnych w tkankach mięśni. Badania przeprowadzono dla dwunastu leków weterynaryjnych należących do różnych grup chemicznych.
Część eksperymentalna
Analizę pozostałości leków weterynaryjnych w mięśniach prowadzono przy pomocy ultrasprawnego chromatografu cieczowego Agilent Technologies HPLC seria 1290 Infinity sprzężonego z spektrometrem mas wysokich rozdzielczości Agilent Technologies 6550 iFunnel Q-TOF LC/MS wyposażonego w źródło jonów ESI Agilent Technologies Jeat Stream. Rozdział chromatograficzny przeprowadzono na kolumnie Agilent Zorbax Plus C18, 2,1 x 100mm, średnica ziarna: 1,8 µm. Jako fazę ruchomą stosowano 0,1% kwas mrówkowy w wodzie (A) i w aceonitrylu (B). Elucja liniowa gradientowa 5 do 95% B w 15 min, 95%B przez 5 min, kondycjonowanie kolumny 3 min, szybkość przepływu fazy ruchomej 0,3 ml/min. Zbierano jonów dodatnie w trybie skan oraz all-ions, energia kolizji 0 eV, 20 eV i 40 eV. Ekstrakcję leków weterynaryjnych z rozdrobnionych kawłków mięśni prowadzono za pomocą mieszaniną acetonitrylu z metanolem (80:20 v/v) w obecności siarczanu amonu i bezwodnego siarczanu sodu. Ekstrakt oczyszczano na kolumienkach SPE.
Wyniki
W pierwszym etapie badań w celu przygotowania bazy widm roztwory wzorców dwunastu badany leków weterynaryjnych o zróżnicowanej budowie chemicznej (tab. 1) poddano analizie LC/MS/MS. Uzyskane widma fragmentacyjne (CID, ang. collision induced dissociation) posłużyły w dalszych etapach prac do identyfikacji leków w mięśniach. Rysunek 1 przedstawia przykładowe widma LC/QTOF kwasu nalidyksowego i tiamuliny.
Tabela 1. Badane leki weterynaryjne
|
Nazwa (angielska) |
wzór |
masa |
RT (min) |
masa zmierzona |
różnica mas [ppm] |
|
Carbadox |
C11H10N4O4 |
262,0702 |
8,35 |
262,0701 |
0,11 |
|
Cefalexin |
C16H17N3O4S |
347,0940 |
3,91 |
347,0937 |
0,76 |
|
Danofloxacin |
C19H20FN3O3 |
357,1489 |
4,66 |
357,1494 |
-1,5 |
|
Enrofloxacin |
C19H22FN3O3 |
359,1645 |
4,82 |
359,1649 |
-1,06 |
|
Erythromycin |
C37H67NO13 |
733,4612 |
8,49 |
733,4621 |
-1,14 |
|
Malachite Green |
C23H25N2 |
329,2018 |
10,39 |
329,2024 |
-1,2 |
|
Nalidixic acid |
C12H12N2O3 |
232,0848 |
8,56 |
232,0851 |
-1,27 |
|
Oxytetracycline |
C22H24N2O9 |
460,1482 |
4,24 |
460,1487 |
-1,4 |
|
Penicillin G |
C16H18N2O4S |
334,0987 |
4,34 |
334,0984 |
0,89 |
|
Spiramycin I |
C43H74N2O14 |
842,5141 |
5,68 |
842,5138 |
0,3 |
|
Tiamulin |
C28H47NO4S |
493,3226 |
8,69 |
494,3296 |
0,48 |
|
Troleandomycin |
C41H67NO15 |
813,4511 |
10,19 |
813,4507 |
0,47 |
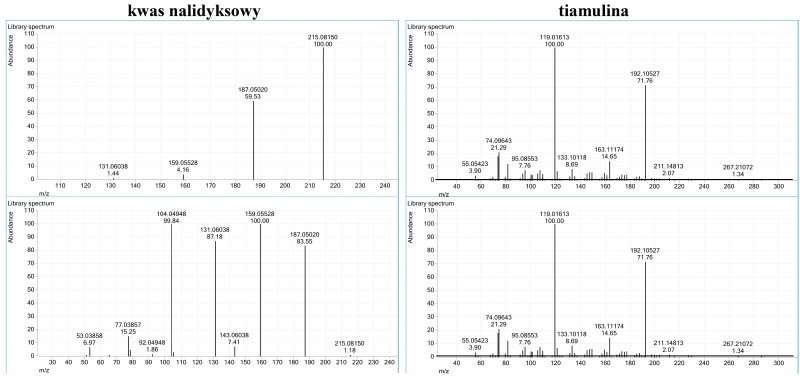
Rys. 1. Widmo LC/QTOF kwasu nalidykowego i tiamuliny uzyskane przy energii kolizji 20 eV (górne) i 40 eV (dolne)
Aby dokonać oceny możliwości wykorzystania LC/QTOF do szybkiego i wiarygodnego wykrywania i identyfikacji pozostałości leków weterynaryjnych w tkankach mięśni próbkę mięśni skażono dwunastoma lekami weterynaryjnymi na poziomie 100 ppb. Skażone próbki poddano ekstrakcji. Otrzymany ekstrakt poddano analizie LC/QTOF w trybie skanu wszystkich jonów (ang. all-ions). Podczas eksperymentów w trybie all-ions spektrometr masowy QTOF pracuje w trybie skan. Wszystkie związki eluujące z kolumny są jonizowane w źródle jonów, przechodzą przez kwadrupol, a następnie trafiają do celi kolizyjnej a później do analizatora czasu przelotu jonów. Kwadrupol celi kolizyjnej pracuje naprzemiennie jako:
– analizator transferujący jony – energia kolizji 0 eV, wszystkie jony macierzyste wytworzone w źródle jonów trafiają do analizatora czasu przelotu jonów oraz
– cela kolizyjna, jony macierzyste ulegają fragmentacji i jony wtórne są kierowane do analizatora czasu przelotu jonów. Fragmentację badanych związków prowadzono przy energii kolizji 20 i 40 eV.
Rysunek 2 przedstawia chromatogram BPC (ang. basic peak chromatogram) ekstraktu z mięśni skażonych lekami weterynaryjnymi oraz chromatogramy EIC (ang. extracted ion chromatogram) wyekstrahowanych dwunastu leków weterynaryjnych. Chromatogram BPC wskazuje, że w ekstrakcie oprócz leków weterynaryjnych obecny jest szereg endogennych związków, które uległy izolacji z mięśni razem z lekami, które stanowią przedmiot analizy.
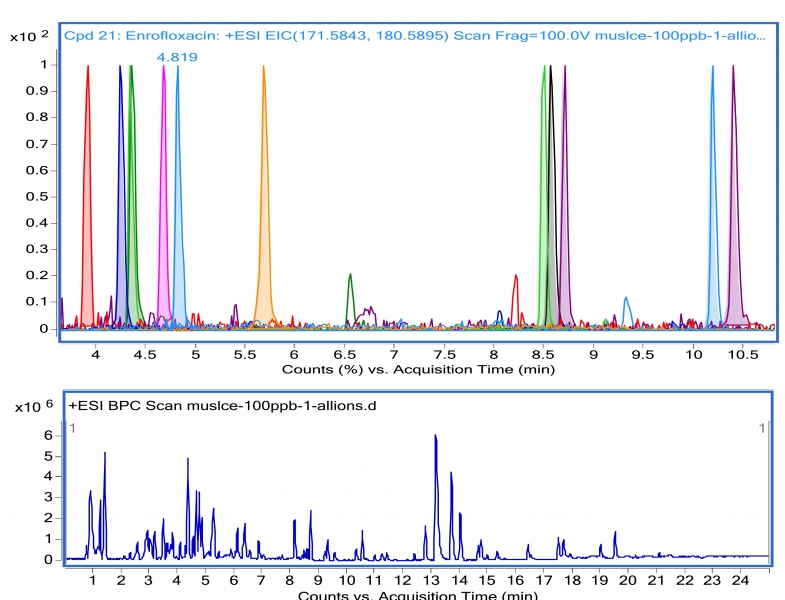
Rys. 2. Chromatogram BPC ekstraktu z mięśni skażonego dwunastoma lekami weterynaryjnymi (dolny)oraz znormalizowane chromatogramy EIC wyekstrahowanych leków weterynaryjnych (górny). Próbka mięśni skażona dwunastoma lekami weterynaryjnymi na poziomie 100 ppb.
Chromatogram EIC ujawnia, że wszystkie dwanaście leków weterynaryjnych uległy izolacji z mięśni. Czasy retencji, zmierzone masy oraz różnice mas teoretycznych i zmierzonych przedstawiono w tabeli 1. Badane związki eluowały pomiędzy 3 i 11 minutą. Dla wszystkich analitów różnica mas teoretycznych i zmierzonych przez QTOF nie przekroczyła 1,5 ppm.
Identyfikacji wykrytych leków weterynaryjnych dokonano na podstawie porównania obecności jonów fragmentacyjnych analitów z przygotowaną bazą widm LC/QTOF. Zidentyfikowano wszystkie dwanaście wyizolowane z mięśni leki weterynaryjne. Na rysunku 3 przedstawiono chromatogramy EIC jonów macierzystych oraz siedmiu charakterystycznych jonów fragmentacyjnych kwasu nalidyksowego i tiamuliny.
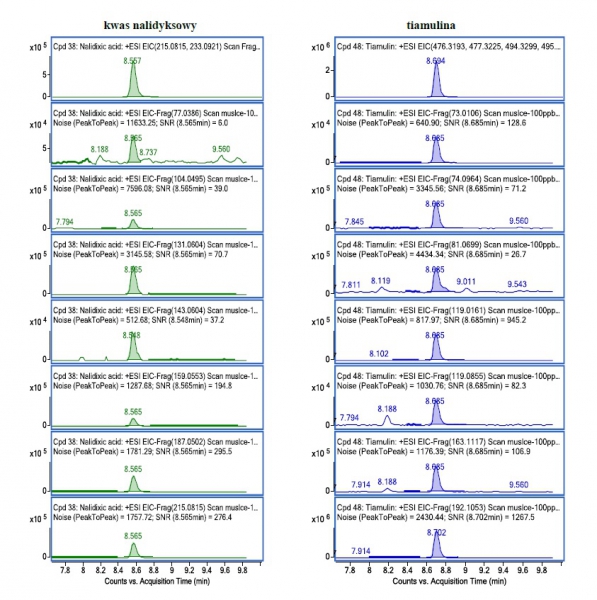
Rys. 3. Chromatogramy EIC jonów macierzystych i fragmentacyjnych a) kwasu nalidyksowego i b) tiamuliny wyekstrahowanych z mięśni. Analiza LC/QTOF all-ions, energia kolizji 0, 20 i 40 eV.
Wnioski
Analizy LC/QTOF umożliwiają szybką, selektywną, czułą i wiarygodną detekcję i identyfikację pozostałości leków weterynaryjnych w próbkach mięśni. Zastosowanie trybu pracy: skan wszystkich jonów (all-ions) pozwala na pewną identyfikację pozostałości (obecność jonów fragmentacyjnych) przy jednoczesnym zapewnieniu wysokiej czułości metody (obecność jonów macierzystych). Pojedyncze oznaczenie w trybie all-ions zapewnia wiarygodną i czułą detekcję i identyfikację analitów nawet w bardzo złozonych matrycach.
Literatura
1. M.L. Gómez-Pérez, R. Romero-González , J.L. Martínez Vidal, A. Garrido Frenich, Food Addit. Contam. A (2015) DOI: 10.1080/19440049.2015.1023742.
2. C. Boix, M. Ibáñez, J.V. Sancho, L. Nuria, V. Yusá, F. Hernández, Food Chem. 160 (2014) 313.
3. M.D.M. Aguilera-Luiz, R. Romero-González, P. Plaza-Bolaños , J.L.M. Vidal, A.G. Frenich, High-Throughput Analysis for Food Safety, Wiley Blackwell, ISBN: 9781118396308, 2014, p. 16.
4. W. Jia, X. Chu, Y.Ling, J. Huang, J.Chang, J. Chromatogr. A. 1347 (2014) 122.
5. S.B.Turnipseed , J.J. Lohne, J.M. Storey, W.C. Andersen, S.L. Young, J.R. Carr, M.R. Madson, J. Agr. Food Chem. 62 (2014) 3660.
6. J. Kang, C.-L. Fan, Y.-F. Cao, H.-J. Wang, X. Peng, Z.-B. Wang, Q.-Y. Chang, X.-Y. Hu, G.-F. Pang, Anal. Methods, 6 (2014) 8337.
7. A.Kaufmann , S. Walker, J. Chromatogr. A 1292 (2013) 104.
Praca została przedstawiona w postaci referatu na VIII Ogólnopolskim Sympozjum „Nauka i przemysł – metody spektroskopowe w praktyce, nowe wyzwania i możliwości”, 9-11 czerwca 2015, Lublin oraz w monografii „Nauka i przemysł – metody spektroskopowe w praktyce, nowe wyzwania i możliwości” pod red. Z. Hubickiego, UMCS, Lublin, 2015.
1Pracownia Zastosowań Metod Separacji i Spektroskopii, Interdyscyplinarne Centrum Badań Naukowych, Katolicki Uniwersytet Lubelski Jana Pawła II, ul. Konstantynów 1F, 20-708 Lublin, tel. 081-445-46-42, e-mail: efronal@kul.pl(link sends e-mail), efornal@poczta.onet.pl(link sends e-mail); 2) Laboratory for Residue Control, Department for Veterinary Public Health, Croatian Veterinary Institute, Savska c. 143, Zagreb, Croatia
