Oznaczanie azotanów w warzywach i w wodzie pitnej metodą potencjometryczną i spektorfotometryczną
Autor: Cecylia Wardak, Małgorzata Grabarczyk, Joanna Reszko-Zygmunt*
W niniejszej pracy przedstawiono badania dotyczące zastosowania nowej jonoselektywnej elektrody azotanowej do oznaczania azotanów w produktach spożywczych. Miarodajność wyników oznaczenia metodą potencjometryczną zweryfikowano wykonując oznaczenie tej samej próbki metodą spektrofotometryczną zgodnie z Polską Normą PN-82/C-04576/08. Dla każdego rodzaju analizowanej próbki uzyskano zadowalającą zgodność wyników oznaczeń co potwierdza przydatność analityczną badanej elektrody azotanowej.
Wprowadzenie
Azotany (V) to sole kwasu azotowego (V) krystaliczne związki o silnych właściwościach utleniających bardzo dobrze rozpuszczalne w wodzie
W środowisku występują jako minerały np. nitratyn oraz nitryt. Obecne są tez w glebie, wodach powierzchniowych i gruntowych oraz w roślinach. Ich źródłem jest naturalny rozkład substancji organicznych (białka roślinne i zwierzęce, odchody hodowlane i komunalne) oraz opady atmosferyczne i ścieki przemysłowe. Azotany (V) są naturalnie obecne w roślinach na skutek ich intensywnego nawożenia.
Do organizmu człowieka dostają się przede wszystkim drogą pokarmową. Najwięcej azotanów spożywamy w warzywach takich jak szpinak, sałata, rzodkiewka, buraki oraz w produktach zbożowych w mięsie i wodzie pitnej. Według Polskiej Normy dopuszczalna zawartość jonów azotanowych (V) w wodzie do picia wynosi 50 mg L-1 (0,806 mM). Dla warzyw maksymalną zawartość azotanów reguluje rozporządzenie Unii Europejskiej. Normy te zależą od okresu i sposobu uprawy i wynoszą odpowiednio [1]: .
– dla sałaty masłowej z upraw gruntowych w okresie 1 X-31 III 4000 mg kg-1;
– dla sałaty masłowej z upraw gruntowych w okresie 1 IV-30 IX 2500 mg kg-1;
– dla sałaty masłowej z upraw pod osłoną w okresie 1 X-31 III 4500 mg kg-1;
– dla sałaty masłowej z upraw pod osłoną w okresie 1 IV-30 IX 3500 mg kg-1;
– dla sałaty lodowej uprawianej w okresie 1 X-31 III 2500 mg kg-1;
– dla sałaty lodowej uprawianej w okresie 1 IV-30 IX 2000 mg kg-1;
– dla szpinaku uprawianego w okresie 1 X-31 III 3000 mg kg-1;
– dla szpinaku uprawianego w okresie 1 IV-30 IX 2500 mg kg-1.
Toksyczność azotanów (V) wynika z możliwości ich redukcji do azotanów (III). Azotany (V) mogą pod wpływem flory bakteryjnej jelit oraz enzymów występujących w ślinie ulec przemianie do azotanów (III). Obecne w przewodzie pokarmowym azotany (III) w reakcji z hemoglobiną tworzą methemoglobinę która nie jest zdolna do transportu tlenu do komórek [2]. Azotany (III) są również uważane za jedną z przyczyn powstawania raka żołądka [3]. Dlatego bardzo ważne jest monitorowanie zawartości azotanów w artykułach spożywczych przede wszystkim w warzywach i w wodzie pitnej.
Prostą, tanią i szybką metodą oznaczania jonów azotanowych (V) jest potencjometria z zastosowaniem elektrod jonoselektywnych. W niniejszej pracy przedstawiono analityczne zastosowanie opracowanej ostatnio jonoselektywnej elektrody azotanowej(V) [4] do oznaczania poziomu azotanów w sałacie, szpinaku
i rzodkiewce oraz w wodzie pitnej.
Część eksperymentalna
Przygotowanie próbki
Próbki wody pitnej analizowano bez wstępnego przygotowania bezpośrednio po pobraniu. Próbki warzyw przygotowano następująco: 5g sałaty, rzodkiewki lub szpinaku rozdrobniono mikserem a następnie zalano wodą dejonizowaną i ogrzewano do 80 ◦ C przez 30 min. Po ostudzeniu roztwór przesączono do kolby miarowej o pojemności 500 mL i uzupełniono wodą do kreski. Każdą próbkę dzielono na dwie porcje. Jedną połowę analizowano metodą potencjometryczną a drugą oznaczano spektrofotometrycznie.
Pomiary potencjometryczne wykonano z użyciem 16-kanałowego systemu zbierania danych (Lawson Labs. Inc. USA) sprzężonego z komputerem. Jako elektrodę odniesienia zastosowano elektrodę chlorosrebrową Orion 90 02 z podwójnym kluczem.
Oznaczenia spektrofotometryczne wykonano według Polskiej Normy PN-82/C-04576/08 z zastosowaniem salicylanu sodu, który w obecności stężonego kwasu siarkowego reaguje z jonami NO3–. W wyniku reakcji nitrowania powstaje kwas nitrosalicylowy, który po zalkalizowaniu przechodzi w postać zdysocjowaną o intensywnym żółtym zabarwieniu. Pomiary absorbancji wykonano przy długości falii 410 nm przy użyciu spektrofotometru Cary 50 Bio UV-V (Varian, Australia).
Wyniki
Przydatność analityczna każdej elektrody jonoselektywnej determinowana jest jej parametrami analitycznymi takimi jak: granica wykrywalności, nachylenie charakterystyki, zakres pomiarowy, selektywność, zakres pH, czas odpowiedzi i stabilność potencjału. Parametry analityczne badanej elektrody azotanowej zamieszczono w tabeli 1.
Tabela 1. Parametry analityczne badanej elektrody azotanowej [3]
|
Parametr |
NO3-ISE |
|
|
Granica wykrywalności, M |
2,8×10−6 |
|
|
Nachylenie charakterystyki, mV/pa |
60,1 |
|
|
Zakres pomiarowy, M |
1×10−5 – 1×10−1 |
|
|
Zakres pH |
3,0-10,0 |
|
|
Czas odpowiedzi, s |
5-10 |
|
|
Dryft potencjału, µV/h |
5,2 |
|
|
Współczynnik selektywności log KpotNOS/X |
H2PO4– |
-5,2 |
|
SO42- |
-4,7 |
|
|
CO32- |
-3,6 |
|
|
CH3COO– |
-3,3 |
|
|
F– |
-3,7 |
|
|
Cl– |
-2,2 |
|
|
NO2– |
-1,8 |
|
|
Br– |
-1,0 |
|
Z analizy parametrów analitycznych elektrody azotanowej wynika, że jest to odpowiednie narzędzie do oznaczania jonów NO3– zarówno w wodzie pitnej jak
i w warzywach. W celu przeprowadzenia oznaczeń wykonano świeże elektrody i wykonano ich kalibrację w roztworach wzorcowych NO3– zawierających 0,01 M CH3COONa jako bufor mocy jonowej. Uzyskana krzywa kalibracyjna przedstawiona jest na rysunku 1.
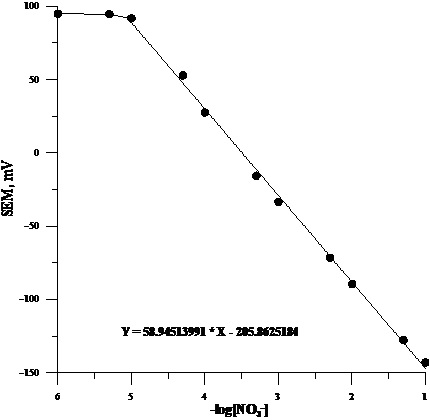
Rys. 1. Krzywa kalibracyjna elektrody azotanowej
Po kalibracji elektrody przemywano wodą destylowaną i zanurzano w badanej próbce. Oznaczenie azotanów wykonano metodą dodatku standardu do próbki.
W próbkach wody pitnej badano także odzysk wzbogacając badane próbki określoną ilością azotanów (V). Badano warzywa z upraw gruntowych rosnące w okresie od 1 kwietnia do 30 września. Dopuszczalna zawartość azotanów dla takich upraw jest niższa niż dla upraw w okresie jesienno-zimowym pod osłonami. Wyniki oznaczeń z zastosowaniem badanej elektrody azotanowej porównano z wynikami uzyskanymi metodą spektrofotometryczną (tabela 2 i 3) .
Tabela 2. Wyniki oznaczania azotanów (V) w wodzie pitnej.
|
Próbka |
Stężenie azotanów wyznaczone metodą potencjometryczną, mM n=5 |
Stężenie azotanów wyznaczone metodą spektrofotometryczną, mM n=5 |
|
Woda wodociągowa |
0,138 ±0,005 |
0,146 ±0,014 |
|
Woda wodociągowa + 0.5 mM |
0,642 ±0,015 |
0,630 ±0,055 |
|
Woda wodociągowa + 1.0 mM |
1,142 ±0,022 |
1,155 ±0,101 |
|
Woda mineralna |
0,048±0,003 |
0,044±0,015 |
|
Woda mineralna + 0.5 mM |
0,550±0,0011 |
0,546±0,046 |
|
Woda mineralna + 1.0 mM |
1,043±0,027 |
1,050±0,110 |
Tabela 3. Wyniki oznaczania azotanów (V) w warzywach.
|
Próbka |
Zawartość azotanów wyznaczona metodą potencjometryczną, mg/kg n=5 |
Zawartość azotanów wyznaczona metodą spektrofotometryczną, mg/kg n=5 |
|
Sałata masłowa |
1946±31 |
1996±121 |
|
Sałata lodowa |
1358±19 |
1311±112 |
|
Szpinak |
1268±21 |
1312±119 |
|
Rzodkiewka |
435±8 |
446±35 |
Wnioski
Wyznaczona zawartość azotanów (V) w każdym przypadku nie przekraczała dopuszczalnej wartości. Wyniki oznaczenia zawartości azotanów (V) metodą potencjometryczną są zgodne z wynikami uzyskanymi metodą spektrofotometryczną- różnice między wartościami uzyskanymi w obu metodach nie przekraczają 10 %. Poprawne wyniki oznaczeń z zastosowaniem nowej elektrody czułej na jony NO3– potwierdzają jej przydatność analityczną.
Literatura
1. M. Iammarino, A. Di Taranto, M. Cristino, Food Chem., 140 (2013) 763.
2. G.M. McKnight, C. W. Duncan, C. Leifert, M.H. Golden, Brit. J. Nutr., 81(1999) 349.
3. M.C. Archer, Cancer Surv., 8(1989) 241.
4. C. Wardak, Electroanalysis, 26 (2014) 864.
*C. Wardak, M. Grabarczyk, J. Reszko-Zygmunt – UMCS, Wydział Chemii, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Lublin.
