Analiza termiczna aspartamu
Markus Schubnell, współpraca z Mettler-Toledo
Aspartam (E951) to sztuczna substancja słodząca stosowana jako zamiennik cukru w wielu produktach spożywczych i napojach w celu zmniejszenia ich kaloryczności. W tym artykule przedstawiono sposób badania właściwości aspartamu metodami analizy termicznej.
Wstęp
Aspartam to sztuczna substancja słodząca, która jest około 200 razy słodsza od sacharozy (cukru stołowego). Wartość energetyczna aspartamu jest mniej więcej taka sama jak cukru stołowego (16 kJ/g lub 3,87 kcal/g). Napoje bezalkoholowe zawierają około 11 g sacharozy na 100 ml, co odpowiada wartości energetycznej około 43 kcal. Jeśli zamiast sacharozy jako substancję słodzącą zastosuje się aspartam, do uzyskania takiego samego poziomu słodkości wystarczy 55 mg. Dzięki temu wartość energetyczna substancji słodzącej zostaje zmniejszona z 43 do 0,215 kcal na 100 ml. Wzory strukturalne sacharozy i aspartamu przedstawiono na rysunku 1.
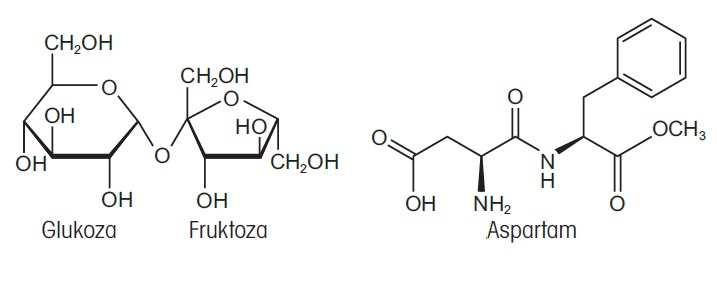
Rysunek 1. Po lewej stronie: sacharoza jest disacharydem składającym się z podjednostek glukozy i fruktozy. Po prawej stronie: wzór strukturalny aspartamu.
Aspartam jest białym, krystalicznym proszkiem, który może występować zarówno jako substancja bezwodna, jak i w różnych postaciach uwodnionych. Dobrze znane postacie to 2,5-hydrat i dwa półhydraty. Te ostatnie różnią się temperaturą dehydratacji. Postać I, którą można uzyskać z postaci II przez zmielenie w młynie kulowym lub przez nawilżanie bezwodnego aspartamu w temperaturze 160°C [2], ulega odwodnieniu w otwartym tyglu w temperaturze około 55°C, a postać II — w temperaturze 100°C. 2,5-hydrat aspartamu jest stabilny tylko przy wilgotności względnej powyżej 58%, dlatego w praktyce jest nieprzydatny.
Ogólnie rzecz biorąc, temperatura odwodnienia hydratów zależy od warunków, w których przeprowadza się pomiar dla uwodnionej próbki: w otwartym tyglu odwadnianie zachodzi w niższej temperaturze niż w tyglu szczelnie zamkniętym przekłuwaną pokrywką. W tym drugim przypadku temperatura odwodnienia zależy również od wielkości otworu. Te aspekty zostaną omówione w niniejszym artykule.
Szczegóły eksperymentu
Analizowaną substancją był bezwodny aspartam (nr CAS 22839-47-0) firmy Sigma Aldrich (numer produktu W700655). Pomiary przeprowadzono za pomocą urządzenia DSC 3+ wyposażonego w czujnik FRS 6+. Wykonano również dodatkowe pomiary za pomocą urządzenia TGA/DSC 3+ połączonego ze spektrometrem masowym (ThermoStar® GSD 350, Pfeiffer) i spektrometrem FTIR (Nicolet iS50, Thermo Fisher). Pomiary przeprowadzono w tyglach aluminiowych o pojemności 40 μl w atmosferze azotu przy prędkości przepływu 30 ml/min.
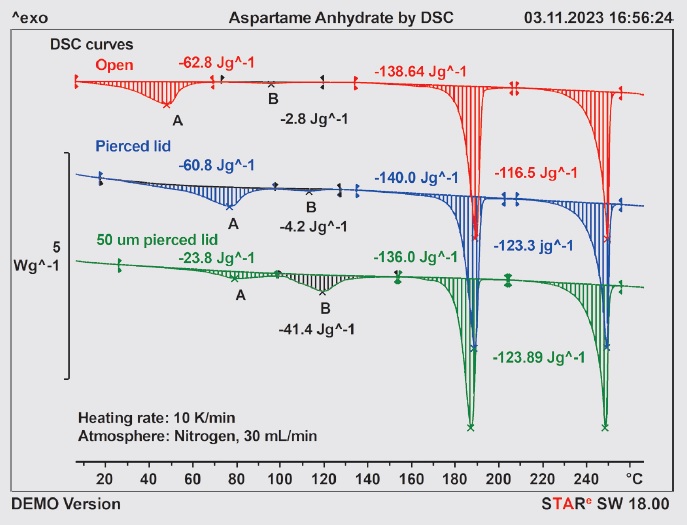
Rysunek 2. Krzywe ogrzewania DSC bezwodnego aspartamu zmierzone przy szybkości 10 K/min w tyglach otwartych, półotwartych i niemal hermetycznie zamkniętych.
Wyniki
Na rysunku 2 przedstawiono krzywe ogrzewania DSC dla świeżego aspartamu z pomiarów:
- w tyglu otwartym (czerwona krzywa),
- w tyglu szczelnie zamkniętym ręcznie przekłuwaną pokrywką z otworem około 1 mm (niebieska krzywa),
- w tyglu szczelnie zamkniętym specjalną pokrywką z otworem 50 μm (zielona krzywa).
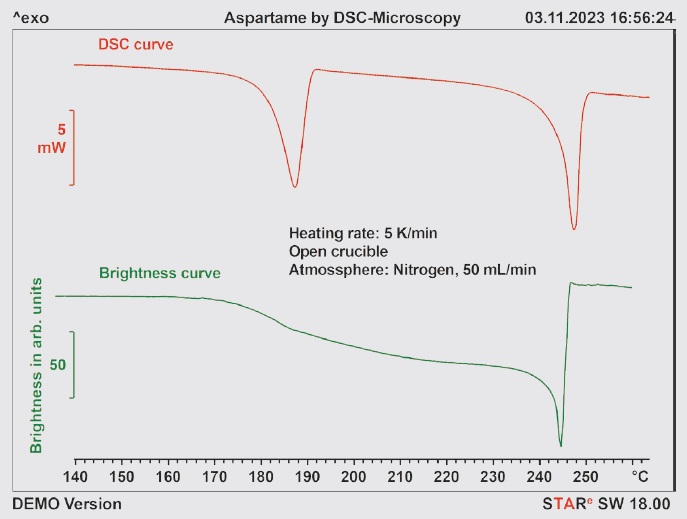
Rysunek 3. Krzywe DSC i jasności próbki zarejestrowane metodą DSC z mikroskopią podczas ogrzewania.
W tyglu otwartym próbka natychmiast zaczyna tracić wilgoć, czemu odpowiada pik endotermiczny (A) występujący od 10°C do około 70°C. W temperaturze około 100°C zauważalny jest niewielki szeroki pik endotermiczny (B), który zinterpretowano jako spowodowany odwodnieniem niewielkiej ilości postaci II półhydratu. Założono, że powstał on podczas ogrzewania z wilgocią obecną w próbce. W temperaturze około 188°C i 249°C pojawiają się dwa ostre piki endotermiczne, których nie można tak łatwo wyjaśnić. Te same piki uzyskano przy użyciu tygli szczelnie zamkniętych przekłuwanymi pokrywkami o różnych rozmiarach.

Rysunek 4. Obrazy próbki w różnych temperaturach podczas ogrzewania.
W porównaniu z pomiarem z użyciem otwartego tygla, w pomiarach wykonywanych z użyciem szczelnie zamkniętych tygli piki generowane przez uwalnianie wilgoci lub wody hydratacyjnej występują w wyższych temperaturach. Można zauważyć, że entalpia spowodowana uwalnianiem wody jest w przybliżeniu taka sama w przypadku wszystkich trzech konfiguracji tygla (otwarty tygiel, pokrywka z otworem około 1 mm, pokrywka z otworem 50 μm). Natomiast stosunek „powierzchni piku spowodowanej uwolnieniem wilgoci” piku A do „powierzchni piku spowodowanej uwolnieniem wody hydratacyjnej” piku B systematycznie maleje. W otwartym tyglu parowanie i dehydratacja są wyraźnie rozdzielone, a stosunek powierzchni piku A do powierzchni piku B wynosi 22,4. W tyglu szczelnie zamkniętym pokrywką z dużym otworem parowanie i dehydratacja nakładają się tylko nieznacznie, a stosunek powierzchni piku A do powierzchni piku B wynosi około 14,5. W tyglu szczelnie zamkniętym przekłuwaną pokrywką z otworem o średnicy 50 μm (tj. w atmosferze samowystarczalnej) dwa procesy nakładają się na siebie, a stosunek powierzchni piku A do powierzchni piku B wynosi około 0,57. Wskazuje to, że wilgoć obecna w próbce podczas ogrzewania prowadzi do powstania pół hydratu. W otwartym tyglu proces ten prawie nie zachodzi, ponieważ wilgoć może łatwo się wydostać. W tyglach zamkniętych przekłuwanymi pokrywkami z dużymi otworami lub otworami 50 μm wydostawanie się wilgoci jest coraz trudniejsze, co powoduje odpowiednie zwiększenie ilości półhydratu powstającego podczas ogrzewania.
Efekty, które prowadzą do powstania dwóch pików endotermicznych w temperaturach 185°C i 250°C, można zbadać, przeprowadzając pomiar dla próbki w otwartej szalce, stosując połączenie metody DSC z mikroskopią. Na rysunku 3 przedstawiono wynikową krzywą DSC wraz ze średnią krzywą jasności obrazów zarejestrowanych podczas ogrzewania próbki. Krzywa DSC zawiera dwa wspomniane wcześniej piki. Na krzywej jasności najpierw widać ciągły spadek jasności. Jest to bardziej widoczne przed pierwszym pikiem DSC i po tym piku. W obszarze drugiego piku DSC w temperaturze około 250°C próbka szybko ciemnieje, a następnie znów staje się jaśniejsza. Na rysunku 4 przedstawiono obrazy próbki zarejestrowane w różnych temperaturach. Podczas zdarzenia około 185°C na krzywej DSC próbka staje się ciemniejsza, ale jej „struktura” pozostaje nienaruszona. Wystąpienie tego piku DSC nie jest zatem (jak można by było przypuszczać) spowodowane procesem topnienia, ale raczej reakcją chemiczną. Pik DSC przy 250°C jest zupełnie inny. W tym przypadku najwyraźniej nakładają się na siebie trzy zdarzenia. Z jednej strony następuje rozkład i topienie się próbki w tym samym czasie, a dodatkowo stopiona próbka szybko przepływa do obrzeża tygla. Prowadzi to do gwałtownego wzrostu jasności obrazu z powodu odbicia światła od dna tygla. Potwierdza to obraz próbki po schłodzeniu przedstawiony na rysunku 5.

Rysunek 5. Tygiel z próbką po ogrzaniu. Stopiona próbka przepłynęła ze środka tygla do jego obrzeża. W temperaturze pokojowej próbka jest szklistą masą.
Powszechnie wiadomo, że w temperaturze od około 160°C wzwyż aspartam ulega reakcji cyklizacji polegającej na eliminacji metanolu (patrz rysunek 6). Pomiar metodą DSC z mikroskopią pokazuje, że powstały produkt ulega dalszemu rozkładowi i topi się w temperaturze około 245°C.
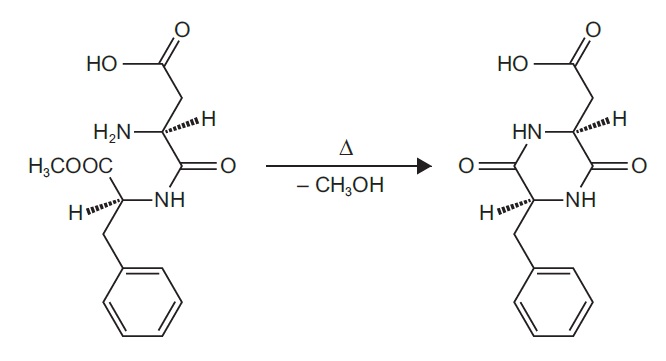
Rysunek 6. Cyklizacja aspartamu do 2,5-dioksopiperazyny z eliminacją metanolu.
Aby sprawdzić ten proces, przeprowadzono pomiar metodą TGA/DSC-MS przy użyciu tygla szczelnie zamkniętego pokrywką z otworem 50 μm. Wyniki podsumowano na rysunku 7.
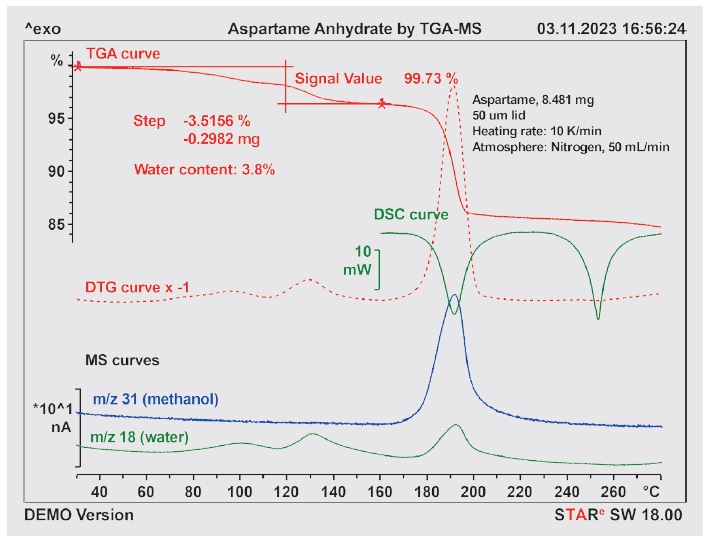
Rysunek 7. Krzywe TGA, TGA/DSC i DTG dla próbki aspartamu wraz z krzywymi jonowymi MS dla m/z 31 (metanol) i m/z 18 (woda). Krzywą DTG pomnożono przez -1, aby ułatwić porównanie z krzywymi MS.
Na krzywej TGA widać kilka nakładających się stopni utraty masy, które wyglądają jak piki na krzywej DTG. Zgodnie z podejrzeniami porównanie z krzywą MS dla m/z 18 (woda) pokazuje, że woda jest uwalniana do temperatury około 170°C (zielona krzywa). Na krzywej dla m/z 31 (metanol) widać wyraźny pik z maksymalną wartością około 190°C, co zgadza się z odpowiednią zmianą masy zarejestrowaną na krzywej TGA. Pik występuje, oprócz krzywej dla metanolu, również na krzywej dla m/z 18 (woda). W tej temperaturze metanol może ulegać rozkładowi termicznemu z utworzeniem wody. Rozkład i topnienie w temperaturze około 244°C oznaczone metodą DSC z mikroskopią można również zaobserwować na krzywej TGA/DSC. Jednak utrata masy między temperaturą 200°C a 260°C jest niewielka. Szybkość utraty masy zaczyna ponownie zwiększać się od temperatury około 260°C. Krzywa MS dla m/z 18 również zaczyna rosnąć w tym zakresie, co wskazuje, że woda występuje jako produkt rozkładu od temperatury 260°C. Przy wilgotności względnej powyżej 58% aspartam może wchłonąć znaczne ilości wody i utworzyć 2,5-hydrat.
Aby zbadać stabilność termiczną tego hydratu, próbkę aspartamu przez kilka dni wystawiano na działanie 100% wilgoci w eksykatorze w temperaturze pokojowej. Nawilżoną próbkę poddano następnie pomiarowi metodami TGA/DSC oraz FTIR online przy użyciu tygla szczelnie zamkniętego z ręcznie przekłuwaną pokrywką. Aby zapobiec utracie masy przed pomiarem, próbkę przygotowano dopiero po osiągnięciu przez urządzenie TGA/DSC temperatury początkowej. Następnie ręcznie wstawiono tygiel i natychmiast rozpoczęto eksperyment. Na rysunku 8 przedstawiono krzywe TGA, TGA/DSC i DTG wraz z chemigramami wody i metanolu.
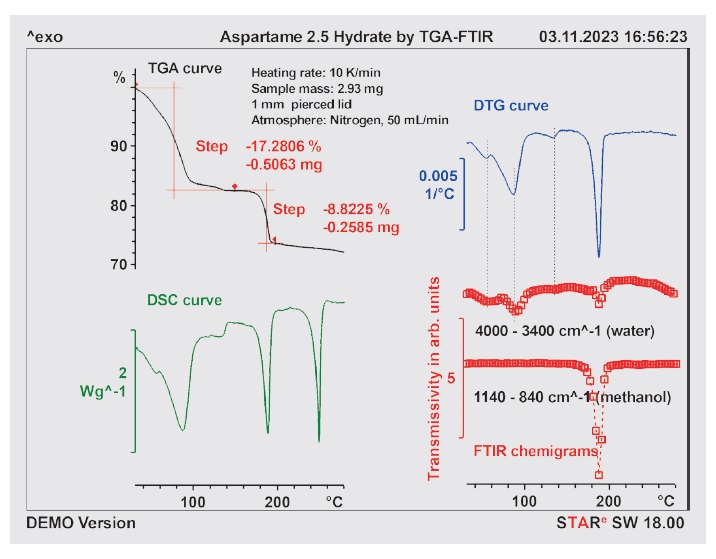
Rysunek 8. Krzywe TGA, TGA/DSC i DTG oraz chemigramy dla wody i metanolu z pomiaru dla wilgotnego aspartamu w tyglu zamkniętym ręcznie przekłuwaną pokrywką (średnica otworu około 1 mm).
Dla próbki wilgotnego aspartamu wykazano dwa nakładające się ubytki masy w temperaturze do około 110°C, które powstają w wyniku uwolnienia wody (patrz chemigram dla wody). Do temperatury około 60°C wodę stanowi głównie woda adsorbowana powierzchniowo, a powyżej 60°C — głównie woda z hydratacji. W tym procesie dwie części wody są usuwane i pozostaje półhydrat aspartamu (postać II). Utrata wody krystalizacyjnej następuje w temperaturze między 120°C a 145°C. Całkowita zawartość wody w nawilżonej próbce wynosi około 17,3%. Z tego 13,3% to woda hydratacyjna, a pozostałość (4%) stanowi wilgoć.
Na podstawie przesłanek stechiometrycznych opartych na bezwodniku (masa cząsteczkowa anhydratu 294,3 g/mol, masa cząsteczkowa metanolu 32,04 g/mol) przewiduje się ubytek masy na poziomie 10,9%. Ocena kroku na krzywej TGA wskazuje na utratę masy wynoszącą zaledwie 8,8%. Różnicę w stosunku do przewidywanego ubytku masy można wytłumaczyć faktem, że ocena kroku opiera się na początkowej masie próbki. Jeśli ubytek masy jest obliczany na podstawie masy próbki bezwodnej, otrzymuje się wartość 10,6%. Jest to zgodne z wartością oczekiwaną, biorąc pod uwagę niepewność limitów oceny.
Wnioski
Aspartam występuje zarówno w postaci bezwodnej, jak i w różnych postaciach uwodnionych. 2,5-hydrat aspartamu zaczyna tracić część wody krystalizacyjnej, rozpoczynając od temperatury pokojowej. Postać II półhydratu jest stabilna w temperaturze do co najmniej 80°C. Bezwodny aspartam cyklizuje endotermicznie do 2,5-dioksopiperazyny od temperatury około 160°C wzwyż z uwalnianiem metanolu. Procesy te zweryfikowano za pomocą pomiarów TGA/DSC-MS i TGA/DSC-FTIR. Za pomocą metody DSC z mikroskopią wykazano, że produkt rozkładu (2,5-dioksopiperazyna) topi się w temperaturze około 245°C, przy czym zachodzi jego dalszy rozkład.
Aspartam nie jest zatem odporny na wysoką temperaturę i może być stosowany jako substancja słodząca (na przykład w wyrobach piekarniczych) tylko wtedy, gdy temperatura podczas pieczenia pozostaje poniżej około 160°C. Powyżej tej temperatury właściwości słodzące aspartamu zanikają. Podczas pomiaru dla próbek, które uwalniają lub pochłaniają „wilgoć” (quasi-wolną i/lub wodę hydratacyjną), sposób zamknięcia tygla ma duży wpływ na kształt krzywych pomiarowych i odpowiednie charakterystyczne temperatury.
Literatura
[1] S. S. Leung, B. E. Padden, E. J. Munson, D. J. W. Grant; Hydration and dehydration behavior of aspartame hemihydrate; J. Pharm. Sci, 508–513, 87, 1998.
[2] S. S. Leung, B. E. Padden, E. J. Munson, D. J. W. Grant; Solid-state characterization of two polymorphs of aspartame hemihydrate; J. Pharm. Sci, 501–507, 87, 1998.
Więcej informacji:
Dr Markus Schubnell, Mettler – Toledo

