Wykorzystanie torfu do usuwania metali ciężkich z wód
Autor: B. Marczewska, R. Kuzioła, M. Szoja*
Torf to naturalna skała osadowa, która wykazuje szereg właściwości fizyko-chemicznych mających zastosowanie między innymi w ochronie środowiska. Jedną z najważniejszych właściwości to zdolność sorpcji w tym metali ciężkich rozpuszczonych w wodach, w których stężenia tych metali mogą przekraczać dopuszczalny poziom i stanowią bardzo poważne zagrożenie dla organizmów żywych. W niniejszej pracy na podstawie wybranych pozycji literaturowych przedstawiono sposoby usuwania metali ciężkich z wód. Stopień oczyszczenia metali ciężkich z wód przez torf badany był stosując techniki spektroskopowe.
Wprowadzenie
Rozwój cywilizacyjny pociąga za sobą wzrost ilości zanieczyszczeń między innymi metali ciężkich, które są emitowane do środowiska. Wiąże się to bezpośrednio z obniżaniem jakości wody, która jest niezbędna do życia i rozwoju wielu organizmów. Uzdatnianie wody to trudny i ważny problem związany z użytkowaniem wody. Stosowane techniki oczyszczania są stosunkowo mało efektywne w porównaniu do ponoszonych kosztów. Z tego powodu podejmowane są ciągle nowe próby wykorzystania do tego celu przede wszystkim tanich substancji naturalnych Jedną z takich substancji jest torf.
Torf występuje w bardzo wielu rejonach świata. Pomimo to, że jest dość powszechny, łatwo dostępny, a obróbka jego jest prosta wykorzystanie jego jest stosunkowo niewielkie. Torf jest skałą osadową organogeniczną. Powstaje w wyniku procesu torfienia, wynikającego z biochemicznych i strukturalnych procesów przemiany szczątków roślinności bagiennej
Torf należy do rodzaju gleb hydromorficznych. Charakteryzują się one słabym drenażem co pozwala na zatrzymywanie przez dłuższy czas wody w środowisku to z kolei sprzyja tworzeniu się zabagnień [1]. Skład torfu zależy od warunków jego powstawania. Torf składa się ze szczątków roślin o różnym stopniu rozkładu, masy humusu oraz substancji nieorganicznych (kwarc, związki żelaza, glinokrzemiany). Składniki nieorganiczne dostają się do torfowisk wraz z wiatrem jako pyły lub wraz przepływającą wodą. Torf to mieszanina złożonych związków organicznych (kwasy humusowe, ich sole, hemiceluloza, bitumina, lignina i białka), które tworzą koloidy hydrofilowe. Do najważniejszych pierwiastków występujących w torfie należą węgiel (50-60% suchej masy), tlen(33-40%), wodór (do 6%) i azot (0,5-4%). Torf w zależności od rodzaju torfowiska, charakteryzuje się odczynem od silnie kwaśnego poniżej pH=4,0 (dla torfów wysokich), o wartościach pH w granicach 4,0-5,0 (torfy przejściowe) i słabo kwaśnych do obojętnego o pH w zakresie 5,0-7,0 (torfy niskie). Wynika to z różnej ilości związków kwasów humusowych i fulwowych oraz stopniem mineralizacji [2].
Ze względu na poziom rozkładu materii organicznej, torfowiska można podzielić na trzy grupy:
1. torfowiska niskie,
Powstają one w dolinach rzek lub na terenach ze źródłami, w procesie torfienia w bogatym w składniki mineralne środowisku wodnym. Wysoki poziomem wód gruntowych może powodować podtapianie, oraz pojawianie się powierzchniowych wód przepływowych bogatych w składniki mineralne oraz tlen. Torf tworzy się z roślinności szuwarowej (trzcina, sity, pałka wodna, mchy zielone, turzyca) oraz leśnej (olcha).
2. torfowiska przejściowe,
Posiadają cechy pośrednie pomiędzy glebami torfów niskich a wysokich. Torfowiska przejściowe są porastane przez roślinność złożoną z różnych gatunków roślin jak turzyce niskie i średnie, mchy zielone czy wełnianki pochwowate.
3. torfowiska wysokie.
Powstają głównie na wododziałach w wyniku torfienia organicznych resztek roślinności bagiennej (torfowce, bagnica, wełnianka) i sosny zwyczajnej w dużym zawilgoceniu.
Obszary torfowe w świecie wg Joosten’a i wsp.[3] wynoszą około 4 milonów km2 z czego około 91% znajduje się w strefie borealnej i subarktycznej. Największe obszary torfowisk zajmują w zachodniej Syberii, Nizinie Hudsońskiej, Azji Południowo-Wschodniej i Rejonie Amazonki. Natomiast największa ich ilość występuje w Rosji, na Białorusi, Ukrainie, w Finlandii, Skandynawii, Estonii, Szkocji, północnych Niemczech, Holandii, Kanadzie, Stanach Zjednoczonych, Nowej Zelandii, Patagonii, Wyspach Kerguelena i na Falklandach. W Polsce Instytut Melioracji i Użytków Zielonych podaje istnienie 50 tys. Torfowisk, z których 36% to potencjalne zasoby wydobywcze. Rozmieszczenie torfowisk w Polsce przedstawia rysunek w pracy [4].
W Polsce torfowiska niskie stanowią 89%, torowiska przejściowe 4,5%, a torfowiska wysokie to 6,5 % [5].Torfowiska w Polsce zajmują obszar 1 706 000 ha co stanowi 5,5% powierzchni całego kraju. Zasoby polskich torfowisk szacowane są na 17 mld m3. Ta ilość ciągle ulega zmianom ze względu nowo udokumentowane torfowiska oraz wydobycie [6].
Torf tzw. „młody węgiel” jest wykorzystywany do budowy domów, jako opał do ogrzewania pomieszczeń mieszkalnych. W XX wieku zaczęto wykorzystywać go jako paliwo w elektrowniach i jest stosowany w tym celu do dziś, ale w niewielkim stopniu. W Polsce użycie torfu jako paliwa energetycznego praktycznie nie ma miejsca. Wydobywany torf w Polsce prawie w całości jest przeznaczony dla potrzeb rolnictwa i ogrodnictwa. Torf dla celów energetycznych musi zostać osuszony. W formie granulatu lub proszku może być spalany w piecach pyłowych lub fluidalnych. Granulat, brykiety, pelety nadają się do transportowanie na duże odległości. Stosowanie torfu jest zwykle nieco droższe od węgla oraz emisja CO2 jest również nieco wyższa [7]. Właściwości torfu zależą od składu zbiorowisk roślinnych, stopnia humifikacji materii organicznej oraz od warunków hydrologicznego zasilania torfów. Najważniejszymi cechami torfu to jego zdolność do pochłaniania i wiązania zanieczyszczeń, właściwości bakteriobójcze, możliwość wytwarzania preparatów leczniczych i nawozu mineralno-organicznego.
Torf pełni rolę naturalnego sorbentu. Zjawiska sorbcyjne są sterowane przez tzw. sorpcyjny kompleks glebowy, który umożliwia regulację odczynu, magazynowanie składników pokarmowych oraz neutralizację szkodliwych substancji dostających się do gleby [8]. Charakter hydrofilowy substancji organicznej torfów oraz ujemny ładunek koloidów powodują, że torf charakteryzuje się bardzo dobrymi właściwościami sorpcyjnymi. Obecność grup o charakterze kwasowym jest wyższa niż o charakterze zasadowym. Powoduje to że torfy odgrywają ważną rolę w wiązaniu kationów. Pojemność sorpcyjna wzrasta w miarę humifikacji masy organicznej. W sorpcji główną rolę odgrywają kwasy huminowe. Zdolność sorpcyjna zwiększa się wraz ze wzrostem wartości pH gleby. Wzrost ten ma na ogół charakter liniowy, ale jest również uzależniony od stopnia rozkładu torfu, jego zamulenia i składu roślin [9].
Torf może być stosowany jako nawóz organiczny. Jest on źródłem substancji organicznych. Stosowanie torfu polepsza właściwości fizyczn gleb mineralnych oraz zwiększa ich produktywność. Polega to na wymieszaniu określonej ilości torfu z glebą mineralną. Dodawanie torfu to swego rodzaju zabieg melioracyjny i zabieg mulczowania pod wszystkie rośliny uprawne. Torf wykorzystywany jest szczególnie w warzywnictwie. Obecnie uprawiane gleby torfowe dają często dwa zbiory w ciągu roku [10].
Torf wykorzystywany jest jako ściółka w stajniach, oborach. Pochłania on dobrze gnojówkę i składniki gazowe wydzielające się z odchodów zwierzęcych. Tak otrzymany obornik może dostarczać do gleby duże ilości wolno rozkładającej się substancji organicznej. Torf ma także zastosowanie jako ściółka w kurnikach i na wybiegach, co wpływa na poprawę warunków hodowlanych.
Borowina jako odmiana torfu (peloidy), powstałego w wyniku humifikacji roślinności bagiennej z udziałem drobnoustrojów. Pokłady borowiny zlokalizowane są przede wszystkim w Europie Środkowej i Wschodniej. Skład chemiczny borowiny zależy od warunków w jakich powstała. Najważniejszym składnikiem jest woda. Zawiera ona mikro- i makroskładniki jak: K, Na, Ca, Fe, Si, Zn, Mn, Mg. W jej skład wchodzą również: hormony, enzymy, antybiotyki, bituminy, składniki mikrobiologiczne oraz kwasy humusowe. Ważnym jest występowanie związków humusowych, zapewniających istnienie układu koloidalnego, regulujących odczyn, warunkujących właściwości sorpcyjno-jonowymienne oraz działania biologiczne. Kwasy huminowe wykazują działanie ściągające (w stosunku do skóry i błon śluzowych), antybakteryjne, przeciwzapalne, aktywizują przemianę materii oraz intensyfikują proces oddychania komórkowego, pobudzają mięśnie gładkie, rozszerzają naczynia krwionośne. Związki humusowe stosowane są do otrzymywania preparatów farmaceutycznych i kosmetyków. W Polsce stosuje się borowiny między innymi w Busku-Zdroju, Ciechocinku, Cieplicach, Dusznikach-Zdroju, Horyńcu-Zdroju, Inowrocławiu, Iwoniczu-Zdrój, Kołobrzegu [11].
Zanieczyszczenia wód metalami ciężkimi
Zanieczyszczenie środowiska metalami ciężkimi może być pochodzenia naturalnego i antropogenicznego. Naturalne zanieczyszczanie spowodowane jest głównie erupcjami wulkanów, wietrzeniem skał, pożarami lasów oraz parowaniem z powierzchni oceanów, natomiast antropogeniczne pochodzą z przemysłów: nawozów sztucznych, elektrotechnicznego, celulozowo-papierniczego, hutniczego i metalurgicznego, szklarskiego, ceramicznego, z cementowni, elektrowni węglowe i przemysłu koksowniczego. Źródłem metali ciężkich są tez ścieki komunalne i przemysłowe, które jeszcze często są odprowadzane bezpośrednio do zbiorników wodnych. Gleby mogą zawierać metale ciężkie pochodzące z nawozów organicznych i mineralnych. Ważnym jest, że metale ciężkie w przeciwieństwie do wielu substancji organicznych nie ulegają rozkładowi [12].
Jednym z najbardziej uciążliwych elementów skażenia środowiska jest wzrastające stężenie metali ciężkich wywołane przez człowieka. Ma on charakter trwały, a oprócz tego metale włączają się do łańcucha pokarmowego pozostając w nim na bardzo długo. Dziłanie ich często ujawniają się po wielu latach. Metale ciężkie ze względu na ich toksyczność i szkodliwość zaliczane są do zanieczyszczeń, które są szczególnie groźne dla zdrowia człowieka [13].
Zanieczyszczenie metalami ciężkimi wód jest szczególnie niebezpieczne, gdyż w naturalnych procesach samooczyszczania nie ulegają całkowitej neutralizacji, a wskutek reakcjom przebiegającym w środowisku wodnym mogą łączyć się z innymi związkami co prowadzi do zwiększonej kumulacji w środowisku. Poprzez biologiczny łańcuch pokarmowy związki metali ciężkich mogą przedostawać się do organizmu ludzkiego, wywołując różne schorzenia.
Metale ciężkie utrudniają naturalne oczyszczanie rzek i ścieków z powodu ich szkodliwej działalności na aktywność mikroorganizmów [14].
Rozporządzenie Ministra Środowiska z dnia 27 listopada 2002r. (Dz. U. Nr 204 poz. 1728). [15] zawiera graniczne wartości stężeń metali ciężkich w wodach powierzchniowych co przedstawiono w tabeli 1.
Tabela 1. Wartości graniczne wskaźników jakości wody w klasach jakości wód powierzchniowych
|
Lp. |
Wskaźnik jakości wody |
Wartości graniczne w klasach I-V [mg/l] |
||||
|
I |
II |
III |
IV |
V |
||
|
1 |
Chrom ogólny |
0,05 |
0,05 |
0,05 |
0,1 |
>0,1 |
|
2 |
Chrom (VI) |
0,02 |
0,02 |
0,02 |
0,04 |
>0,04 |
|
3 |
Kadm |
0,0005 |
0,001 |
0,001 |
0,005 |
>0,005 |
|
4 |
Miedź |
0,02 |
0,04 |
0,06 |
0,1 |
>0,1 |
|
5 |
Nikiel |
0,1 |
0,02 |
0,05 |
0,2 |
>0,2 |
Tabela wykonana na podstawie danych w pracy [15].
Celem niniejszej pracy jest przedstawienie na podstawie dostępnych danych literaturowych możliwości wykorzystania torfu do usuwania z wód metali ciężkich. Badania stężeń metali prowadzono przy pomocy technik spektroskopowych.
Usuwanie metali ciężkich z zastosowaniem torfu
Torf to łatwo dostępny oraz tani materiał, który jest wykorzystywany do usuwania zbędnych substancji z wody i ścieków, wliczając w to nieprzyjemne zapachy. Te właściwości torfu uzależnione są od wielu czynników zarówno chemicznych i fizycznych. Na adsorpcję metali z wód i ścieków ma wpływ stężenie metali w roztworze, siła jonowa, wartość pH i substancje tworzące. W oczyszczaniu wód oprócz zjawiska adsorpcji może mieć miejsce również wytrącanie i uwięzienie mechaniczne [16].
W pracy Brown’a i wsp. [17] torf został poddany badaniom jako sorbent jonów metali. Mechanizm wiązania torfu z jonami metali jest bardzo skomplikowany w porównaniu z wymianą jonową, kompleksowaniem czy adsorpcją. Jako najbardziej efektywny zakres pH dla wychwytywania jonów metali przyjęto wartość w zakresie 3,5 – 6,5. Obecność więcej niż jednego metalu w roztworze powodowało konkurencję, w wyniku czego spadała ilość związanych jonów określonego metalu, natomiast całkowita pojemność sorpcyjna wykazuje wzrost. Badania wykazały, że gdy wartości ładunków metali są niskie usuwanie metali jest bardziej efektywne.
Możliwe jest również odzyskiwanie metali i regeneracja torfu poprzez wymywanie kwasem z bardzo małym wpływem na pojemność sorpcyjną torfu. Procesy granulacji torfu pomagają w uzyskaniu niezawodnego nośnika do wielu różnych zastosowań, gdzie tradycyjne metody usuwania zanieczyszczeń byłyby nie ekonomicznie lub technicznie trudne [17].
MIEDŹ I NIKIEL
Irlandzki torf z Irlandii Północnej wytworzony z mchu zastosowali jako adsorbent Sen Gupta i wsp. [18]. Charakteryzował się on bardzo niskim kosztem. W pracy scharakteryzowano torf pod kątem jego powierzchni, porowatości, objętości porów i oceny właściwości adsorpcyjnych dla jonów Cu2+ i Ni2+.
Próby torfu były płukane przez wytrząsanie 30 minut w roztworze HCl. Następnie filtrowano go i wypłukiwano w wodzie destylowanej, do przesączu o pH= 7 i suszono w piecu w temperaturze 60°C przez 24 godziny. Próby dwukrotnie przepuszczono przez młyn do uzyskania wielkości ziaren torfu przedstawionej w tabeli 2. Stężenie metali ciężkich oznaczano za pomocą techniki ICP-AES. Powierzchnię cząstek analizowano metodą objętościową BET przy użyciu Sorptomatic 1990 stwierdzając, że wynosi ona 203,41m2/g. Zmierzona średnia średnica porów wynosiła 6,1 µm.
Tabela 2. Rozkład wielkości ziaren torfu
|
Rozmiar [µm] |
Średnia waga [g] |
[%] |
|
>355 |
3,9 |
19 |
|
< 355, >150 |
6,9 |
33 |
|
< 150 |
2,6 |
12 |
Tabelę wykonano na podstawie danych w pracy [18].
Badania równowagi adsorpcji prowadzono w temperaturze 25°C przez dodanie 0,4g torfu do 100 ml wodnego roztworu jonów miedzi i niklu. Roztwory z torfem umieszczano w cieplarce i wytrząsano przez 24 godziny. Po tym procesie próby analizowano na zawartość miedzi i niklu. Izotermę adsorpcji uzyskano zmieniając początkowe stężenie jonów miedzi i niklu. Ilość adsorbowanych jonów metalu na jednostkę masy adsorbentu (Qe) obliczono stosując następujące równanie:
Qe= (Ci-Ce)V/M
gdzie:
Ci i Ce – stężenie początkowe i równowagowe [mg/l],
V – objętość roztworu [l],
M – masa adsorbentu [g].
Rysunki 1 i 2 przedstawiają wpływ pH na adsorpcję miedzi i niklu. Torf zasadniczo z uwagi na obecność różnych funkcjonalnych grup, które obejmują alkohole, aldehydy, ketony, kwasy fenolowe, wodorotlenki i etery wykazuje charakter kwasowy. Jony miedzi lub niklu mogą tworzyć kompleks z powierzchniowymi grupami funkcyjnymi torfu, jak aromatyczne związki posiadające grupę -COOH lub grupę -OH. Przy niższej wartości pH, funkcje tych grup nie zmieniają się. Przy wyższym pH, grupy te ulegają zobojętnieniu i zmieniają swoje aktywne właściwości wiążące. W pracy przedstawiono również prawdopodobny mechanizm wiązania z różnymi grupami funkcyjnymi (rys. 3).
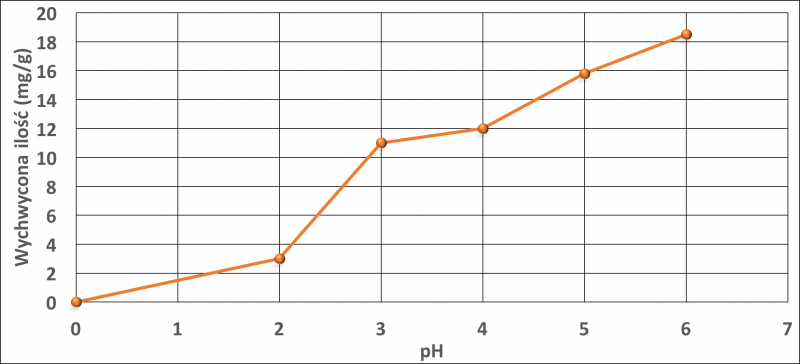
Rys. 1. Wpływ pH na wychwyt miedzi przez torf przy początkowym stężeniu 100 mg / l w 25°C. Rysunek wykonany na podstawie danych w pracy [18].
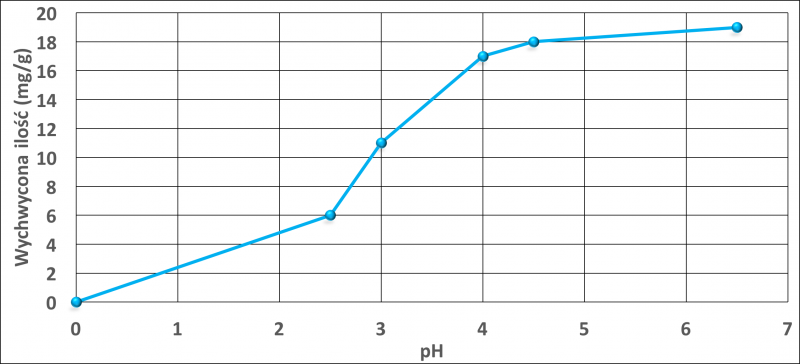
Rys. 2. Wpływ pH na wychwyt niklu przez torf przy początkowym stężeniu 100 mg / l w 25°C. Rysunek wykonany na podstawie danych w pracy [18].
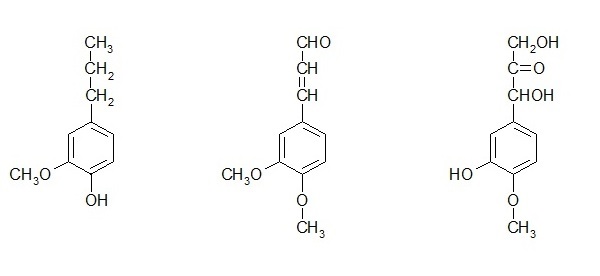
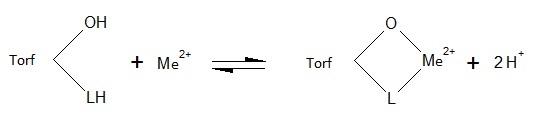
Rys. 3. Mechanizm wiązania torfu z jonami metali. Rysunek wykonany na podstawie danych w pracy [18].
Adsorpcję miedzi na torfie badano w zakresie pH 2,0-6,0. Najlepsze wyniki otrzymano w zakresie pH 4,0-4,5. Maksymalna zdolność adsorpcji torfu wynosiła 17,6 mg/g dla Cu oraz 14,5 mg/g dla Ni.
Prawie 60% masy Cu2+ i Ni2+ adsorbowało się w ciągu pierwszych 60 minut [18]. Rysunki 4 i 5 przedstawiają wpływ początkowego stężenia jonów w roztworze na wychwyt jonów metali.
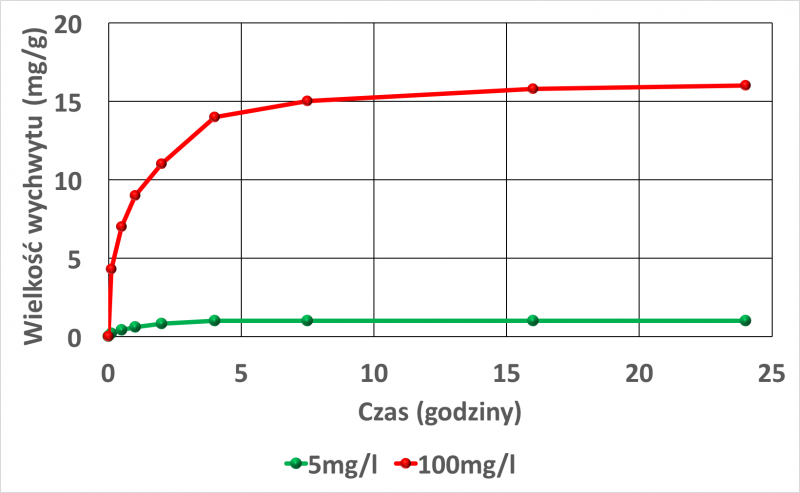
Rys. 4. Wychwyt jonów miedzi, jako funkcja czasu w zależności od różnych stężeń jonów w roztworze. Początkowe stężenie miedzi w roztworze 100 mg / l, oraz 5 mg /l.Rysunek wykonany na podstawie danych w pracy [18].
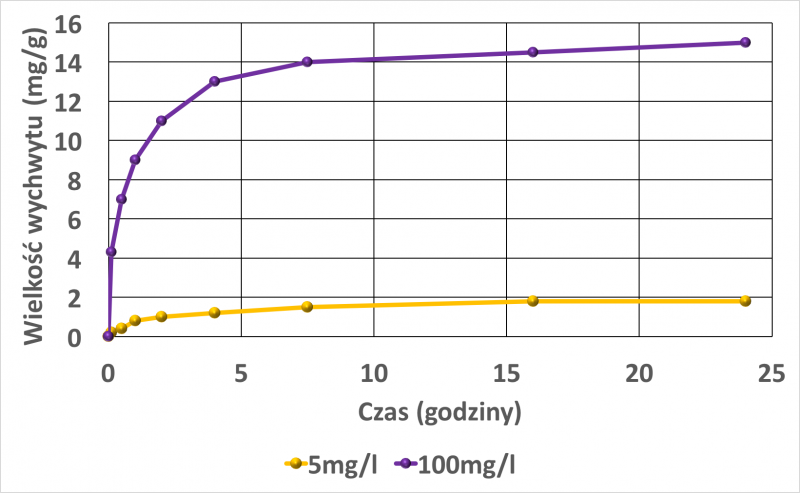
Rys. 5. Wychwyt jonów niklu, jako funkcja czasu w zależności od stężeń jonów w roztworze. Początkowe stężenie niklu w roztworze 100 mg / l, oraz 5 mg /l.Rysunek wykonany na podstawie danych w pracy [18].
Torf z torfowego obszaru Gavurgolu w prowincji Kahramanmaras w Turcji, wykorzystali w swych badaniach Gündogan i wsp. [19]. Próba torfu była suszona w temperaturze 105°C, a następnie stosowana w badaniu adsorpcji po przesianiu przez sito (100 oczek na cal). Badania adsorpcji partii torfu przeprowadzono stosując 0,5 g torfu z 50 ml CuSO4·5H2O. Początkowe stężenia miedzi zmieniano od 3∙10-4 M do 6∙10-4 M. Mieszaniny torfu i roztworu miedzi wirowano w kontrolowanej temperaturze na łaźni wodnej. Zawiesiny przesączono przez bibułę filtracyjną. Przesącz analizowano na zawartość jonów Cu2+ przy użyciu spektrometru absorpcji atomowej (Perkin-Elmer 3110). Ilość zaadsorbowanych jonów Cu2+ przez torf określano z różnicy pomiędzy stężeniem początkowym a końcowym roztworów. Stosując tę metodę usuwano jony Cu2+ aż do 97% .
CHROM
Wiele materiałów było testowanych pod kątem usuwania chromu z wód i ścieków. Wiele z nich to żywice jonowymienne, czy też zmodyfikowane włókna naturalne lub chemicznie zmodyfikowane biomasy. We wszystkich przypadkach koszt materiału stosowanego do usuwania chromu był wyższy. W pracy [20], naturalny torf został przetestowany jako potencjalny adsorbent chromu na szóstym stopniu utlenienia. Do badań stosowano komercyjny produkt Biomatrix Gold (Mérida, Spain) stosowany do usuwania organicznych zanieczyszczeń ze ścieków. Właściwości torfu scharakteryzowano pod kątem uziarnienia, popiołu, właściwości termicznych i pH. Badania przeprowadzono stosując 0,1 g torfu w kontakcie z 20 ml wodnego roztworu dwuchromianu potasu o początkowym stężeniu równym 4∙10-3 M. Badania adsorpcji prowadzono w czterech różnych temperaturach: 15, 25, 35 i 45°C w Selecta Unitronic-O (termostatowa łaźnia z wytrząsarką). Stężenie Cr (VI) w roztworze oznaczano po upływie zadanego czasu, przy pomocy Thermo Electron S Series, absorpcyjnego spektrofotometru atomowego. Na rysunku 6 przedstawiono adsorpcję chromu (VI) temperaturze 25 i 45oC.
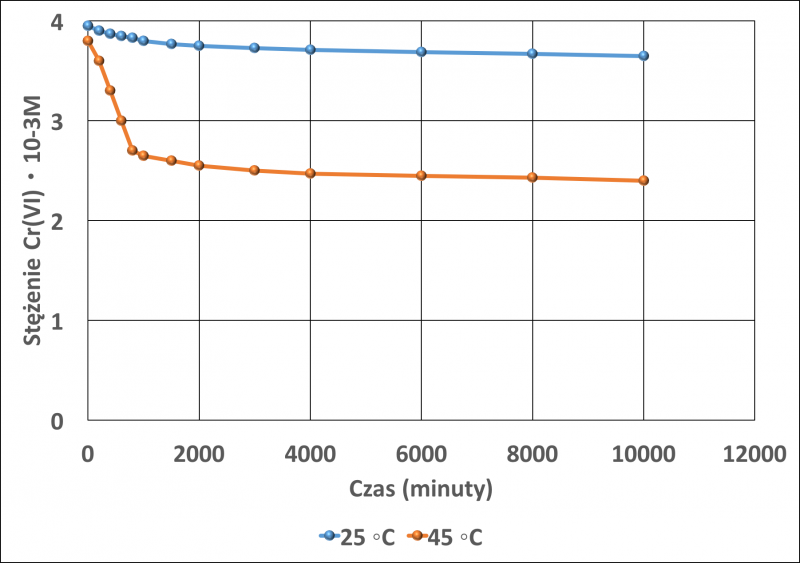
Rys. 6. Adsorpcja chromu (VI) w roztworze wodnym w różnych temperaturach.Rysunek wykonany na podstawie danych w pracy [20].
KADM
Fine i wsp. [21] do oznaczania adsorpcji kadmu wykorzystali torf kwaśny pochodzący z Finlandii (Kekkila, Finland). Próbki torfu były suszone na powietrzu następnie umieszczono je w butelkach z polietylenu w stosunku 1:10 z wodą i mieszano 2 godziny. Mieszaniny następnie odsączano. Zdolność torfu do sorpcji kadmu została ustalona w następujący sposób: 1 g próby liofilizowanego torfu umieszczono w probówce do wirowania wraz z 25 ml Cd(NO3)2, a następnie wytrząsano przez 24 godziny. Początkowe zawartości kadmu w roztworach to 5, 10 i 50 g/l. Otrzymaną zawiesinę Cd przepuszczono przez filtr Whatmana nr. 542. Następnie określano stężenie Cd w przesączu. Wykonano również pomiary z aktywowanym torfem 1M NaOH i 1M HCl.
Torf aktywowany NaOH wykazuje najwyższy wychwyt Cd wśród wszystkich próbek, pozwalając na wychwycenie prawie 80% rozpuszczonego metalu z roztworu zawierającego 5g/l. Rysunek 7 przedstawia początkową zawartość kadmu w torfie oraz ilość usuniętą przez torf.
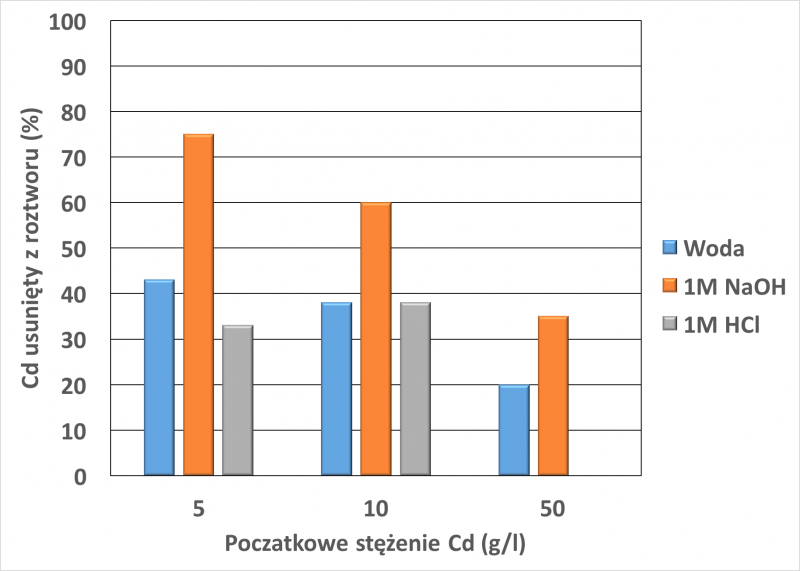
Rys. 7. Ilość Cd usunięta z roztworu przez próbki kwaśnego torfu z użyciem odmiennych aktywacji i ekspozycji na różne stężenia Cd(NO3). Rysunek wykonany na podstawie danych w pracy [21].
Li i wsp. [22] przeprowadzili badanie w celu określenia skuteczności kwaśnego torfu jako naturalnego i taniego materiału filtracyjnego do usuwania jonów kadmu i niklu z roztworów wodnych. Ich metoda opierała się na przepuszczaniu wodnych roztworów metali przez kolumny wypełnione w różnym stopniu torfem. Podczas badania kolumn ze złożem torfu o wysokości 15cm stwierdzono znacznie lepsze warunki pracy, w których uzyskano usunięcie 47,9% kadmu i 42,7% niklu.
Wnioski
· Torf jako naturalny materiał wykazujący właściwości sorpcyjne, w porównaniu z syntetycznymi materiałami jest znacznie bardziej ekonomiczny.
· Skład wody oraz wartość pH mają decydujący wpływ na efektywność usuwania metali ciężkich.
· Działanie torfu ma miejsce w dość wąskich zakresach pH.
· Metody usuwania metali ciężkich z użyciem torfu nie są skomplikowane i ograniczają się do przepuszczenia wód przez torf, bądź wymieszania ich razem z torfem jednocześnie są efektywne
· Torf wykazuje się też innymi właściwościami jak zdolność do pochłaniania obcych zapachów lub odorów.
Literatura
1. S. Tołpa S., Torfy i torfowiska, Wrocław – Warszawa 1949.
2. R. Bednarek, H. Dziadowiec, U. Pokojska, Z Prusinkiewicz, Badania ekologiczno-gleboznawcze, PWN, Warszawa 2004.
3. H. Joosten, D. Clarke., Wise use of mires and peatlands – Background and principles including a framework for decision-making. Saarijärvi: International Mire Conservation Group, International Peat Society, 2002.
4. https://pl.wikipedia.org/wiki/Torf, z dnia 27.07..2016.
5. M. Jasnowski, Znaczenie torfowisk w Polsce i ich ochrona w: Ochrona i kształt środowiska
przyrodniczego. Pr zbior. pod red. W. Michajłowa i K. Zabierowskiego, PWN, Warszawa –Kraków 1978.
6. D. Hillel, Gleba w środowisku, przekład z języka angielskiego, Jowanka Różańska, PWN, Warszawa 2012.
7. G. Ozaist, Energia z torfowiska, Polska Energia, 7 (2012) 22-23.
8. J. Kyzioł-Komosińska, L. Kukułka, Wykorzystanie kopalin towarzyszących pokładom złóż węgli brunatnych do usuwania metali ciężkich z wód i ścieków, Instytut Podstaw Inżynierii Środowiska Polskiej Akademii Nauk, Zabrze 2008.
9. J. Marcinek, Pojemność sorpcyjna gleb torfowych w zależności od pH i stopnia rozkładu masy organicznej, Katedra Gleboznawcza WSR, Poznań 2013.
10. H. C. Buckman–Nyle, C. Brady, Gleba i jej właściwości, przekład z języka angielskiego pod redakcją B. Dobrzańskiego, Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa 1971.
11. M. Majcher-Kozieł M., Borowina właściwości lecznicze i kosmetologiczne, Chemia w Szkole, 4(2013) 42-44.
12. F H. Florczyk, S. Gołowin, Metale ciężkie w wodach płynących powierzchniowych Polski, Instytut Meteorologii i Gospodarki Wodnej Oddział we Wrocławiu 1980.
13. W. Seńczuk, A. Starek, Toksykologia Współczesna, Wydawnictwo Lekarskie PZWL, Warszawa 2006.
14. J.N.B. Bell, M. Treshow, Zanieczyszczenie powietrza a życie roślin, WNT, Warszawa 2004.
15. Dz. U. 2002 nr 204 poz. 1728
16. L. Ringqvista, A. Holmgrenb, I. Öborn, Poorly humified peat as an adsorbent for metal in wastewater, Water Research, 36 (2002) 2394–2404.
17. P.A. Brown, S. A. Gill, S. J. Allen, Metal removal from wastewater using peat, Water Research 34 (2000) 3907-3916.
18. B. Sen Gupta, M. Curran, S. Hasan S.,T. K. Ghosh T, Adsorption characteristics of Cu and Ni on Irish peat moss, Journal of Environmental Management, 90 (2009) 954–960.
19. R. Gündogan, B. Acemioglu, B. Hakkı, M. Alma, Copper (II) adsorption from aqueous solution by herbaceous peat, Journal of Colloid and Interface Science, 269 (2004) 303–309.
20. A. León-Torres, E.M. Cuerda-Correa, C. Fernández-González, M. F. A. Franco,
V.Gómez-Serrano, On the use of a natural peat for the removal of Cr(VI) from aqueous solutions, Journal of Colloid and Interface Science, 386 (2012) 325–332.
21. P. Fine, A. Scagnossi, Y. Chen, U. Mingelgrin, Practical and mechanistic aspects of the removal of cadmium from aqueous systems using peat, Environmental Pollution, 138 (2005) 358-367.
22. C. Li, P. Champagne, Fixed-bed column study for the removal of cadmium (II) and nickel (II) ions from aqueous solutions using peat and mollusk shells, Journal of Hazardous Materials, 171 (2009) 872–878.
*KUL, Instytut Inżynierii Środowiska, Katedra Chemii Analitycznej Środowiska, Stalowa Wola
Temat przedstawiony w artykule był prezentowany podczas sympozjum “Nauka I przemysł – metody spektroskopowe w praktyce, nowe wyzwania i możliwości” (Lublin 2016). Jest również opublikowany w monografii pod tym samym tytułem.
