Zastosowanie luminometrii w badaniach adhezji drobnoustrojów do powierzchni abiotycznych
Autor: Dorota Kręgiel
Od czasu, gdy pod koniec XIX wieku Robert Koch przedstawił teorię, że choroby powodowane są przez zarazki, ludzie wyobrażali sobie bakterie jako pojedyncze komórki, które pływają lub unoszą się w środowisku płynnym, w tym również w niektórych częściach ludzkiego ciała. Pogląd taki wynikał również z faktu, że drobnoustroje obserwowano w kropli wiszącej.
Rozwój mikrobiologii i metod analitycznych pozwolił na skorygowanie tego wyobrażenia. Okazało się, że wiele drobnoustrojów szybko osiedla się na różnych wilgotnych powierzchniach, tworząc zróżnicowane gatunkowo zespoły, tzw. biofilmy. Bakterie nie są jedynymi mikroorganizmami zdolnymi do tworzenia takich warstw – często w ich tworzeniu mają udział drożdże, grzyby strzępkowe, a w określonych środowiskach także glony i pierwotniaki. Różnorodność drobnoustrojów tworzących takie zespoły oraz rozmaitość środowisk, w których występują, świadczą, że umiejętność ta stanowi prastarą „strategię” rozwoju mikroorganizmów. Biofilmy występują niemal wszędzie – płytka nazębna, śliski nalot na powierzchni skały w strumieniu czy osad, pokrywający po kilku dniach wewnętrzne ścianki wazonu z kwiatami. Powstają także w paszy zjedzonej przez bydło i inne przeżuwacze, na powierzchni soczewek kontaktowych, przyczyniają się do powstawania chorób przyzębia, kamicy moczowej, gruźlicy, choroby legionistów i in. Z tworzenia biofilmów wynikają także poważne problemy w procesach technologicznych. Gdy biofilm powstanie w przemysłowych wymiennikach ciepła, przewodach doprowadzających ciecze, tankach fermentacyjnych, wzrasta zagrożenie korozją (biodeterioracja). Warstwa mikroorganizmow formująca się na powierzchni maszyn i urządzeń technologicznych może powodować ograniczony przepływ mediów, utrudnioną wymianę ciepła, wzrost tarcia na elementach ruchomych, zapychanie się filtrów i awarie urządzeń. W przemyśle spożywczym mikrobiologiczne zanieczyszczenie powierzchni kontaktujących się z żywnością może być przyczyną zakażenia środowisk produkcyjnych drobnoustrojami chorobotwórczymi oraz powodującymi jej zepsucie.
Zjawisko adhezji
Proces tworzenia biofilmu przebiega w sposób wielostopniowy i polega na kilku procesach:
- adsorpcji,
- adhezji,
- adherencji.
Adsorpcja jest powszechnie definiowana jako proces wiązania substancji na powierzchni substancji stałej. Zjawisko to jest wywołane tworzeniem wiązań jonowych, wodorowych, kowalencyjnych lub występowaniem sił Van der Waals’a. Procesy te umożliwiają adsorpcję warstwy organicznej ze środowiska wodnego i wytworzenie tzw. warstwy kontaktowej. Gromadzenie się substancji organicznych tworzy swoisty gradient pokarmowy skoncentrowany przy powierzchni ciała stałego, co stwarza dogodne warunki do rozwoju mikroorganizmów i w konsekwencji sprzyja adhezji komórek (rys. 1).
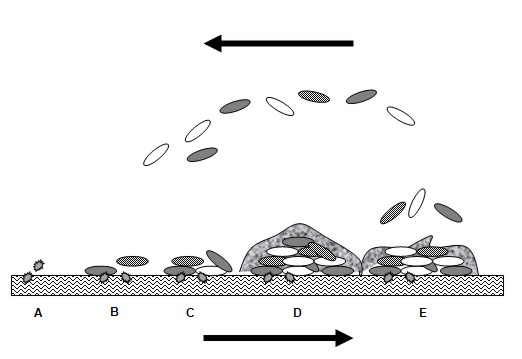
Rys. 1. Etapy powstawania biofilmu A – tworzenie warstwy kontaktowej, B – początek adhezji komórek, C – tworzenie mikrokolonii, D – dojrzały biofilm, E – odrywanie się komórek od biofilmu.
Adhezja w sensie biologicznym jest trwałym i nieodwracalnym połączeniem się komórki drobnoustroju z powierzchnią ciała stałego. Kluczową rolę w adhezji komórek do powierzchni odgrywają dwa rodzaje oddziaływań: przyciągające siły Van der Waalsa oraz odpychające siły elektrostatyczne związane z podwójną warstwą elektronową wokół komórki. Siły te działają na dystansie od 1 do 50 nm i decydują o zbliżeniu komórek do powierzchni ciał stałych na tyle blisko, aby powstały wiązania chemiczne trwale łączące oba obiekty. Całkowita wolna energia interakcji między komórką a powierzchnią ciała stałego jest wypadkową obu sił i decyduje ona o możliwości zbliżenia komórki bakteryjnej do ciała stałego. Największe przyciąganie następuje w obszarze tzw. minimum energetycznego, występującego na bardzo małej odległości, rzędu 1 nm. Pokonanie tego dystansu zależy w dużym stopniu od kształtu komórek. Im wykazują one mniejszy promień w miejscu styku powierzchni, tym łatwiej pokonać komórce siły odpychania i przejść z drugiego do pierwszego obszaru minimum energetycznego. Zwiększa to szanse na procesy adhezji komórek o kształtach wydłużonych lub posiadających wydłużone struktury komórkowe – fimbrie lub rzęski. Istotne znaczenie na procesy adhezji w roztworach wodnych mają siły związane z ruchami Browna oraz interakcje hydrofobowe. Miarą adhezji jest praca potrzebna do rozdzielenia przylegających do siebie warstw o jednostkowej powierzchni. Adherencja (adhezja specyficzna) wiąże się głównie z oddziaływaniami mikrobiologicznymi, powodującymi unieruchamianie komórek, np. produkcją zewnątrzkomórkowych polimerów, zmianami metabolicznymi i genetycznymi oraz warunkami środowiska.
Mikroorganizmy tworzące biofilm zajmują tylko od 5% do 25% jego całkowitej objętości, a pozostałą część stanowią pozakomórkowe polimerowe związki o właściwościach hydrofobowych. Substancje te, produkowane przez część mikroorganizmów tworzących biofilm, nie są wydzielane do podłoża, lecz ściśle przylegają do powierzchni komórki. Ponadto wykazują one specyficzność gatunkową, a ich synteza zależy od warunków środowiskowych i podlega złożonej regulacji. Mieszanina wody i EPS tworzy galaretowatą substancję, w której jony wapnia zastępują kwasowe protony polimerów. Tym samym typowy biofilm wykazuje dużą trwałość w środowiskach wodnych.
Czynnikiem warunkującym powstawanie biofilmów jest również rodzaj i charakter powierzchni. Powierzchnie szorstkie, nieregularne są szybciej zasiedlane przez bakterie niż materiały o powierzchni gładkiej. Wielu autorów wykazało wzrost adhezji drobnoustrojów wraz ze wzrostem chropowatości powierzchni, inni nie wykazywali korelacji pomiędzy nieregularnościami powierzchni a zdolnością drobnoustrojów do przylegania. Zatem zależność ta może być również determinowana wielkością komórki mikroorganizmu. Jeżeli jej wymiary są większe niż wielkość por danej powierzchni, adhezja może być utrudniona. Dotyczy to szczególnie komórek grzybów, których wymiary są dużo większe niż bakterii.
Warunki odżywcze środowiska także wpływają na rozwój drobnoustrojów. Synteza EPS jest stymulowana w warunkach ubogich w składniki odżywcze, ale mechanizmy tego zjawiska nie zostały wyjaśnione. Mikroorganizmy w warunkach głodowych szybciej ulegają adsorpcji do substratu, a szybkość desorpcji jest prawie równa zeru. Czynnikiem, który znacząco wpływa na adhezję jest także faza wzrostu drobnoustrojów. Komórki w fazie wzrostu logarytmicznego znacznie szybciej i w większym stopniu ulegają adhezji niż komórki z fazy stacjonarnej.
Luminomeria
Luminometria wykorzystuje reakcje hydrolizy ATP do ADP i ortofosforanu lub do AMP i pirofosforanu, gdzie uwalniana jest pewna ilość energii swobodnej, którą można zmierzyć jako emisję kwantów światła. Zjawisko to nosi nazwę chemoluminescencji, a w przypadku katalizowania jej przez enzym – bioluminescencji. Bioluminescencja polega na enzymatycznym utlenianiu specyficznego substratu – lucyferyny (L) do formy utlenionej (E:LO*), którą charakteryzuje podwyższony stan energetyczny. Jednak kompleks E:LO powraca do niższego stanu energetycznego emitując energię w postaci światła.
L + E -> E:LO* -> E:LO + CO2 + hn (465 nm).
Intensywność wydzielanego światła jest proporcjonalna do ilości ATP obecnego w komórkach organizmów.
Zdolność bioluminescencji wykazują niektóre istoty żywe bytujące w wodach morskich lub oceanicznych: ryby, pierwotniaki, meduzy, kałamarnice i rośliny. Zdolność emisji światła wykazują także niektóre żuki (świetliki), grzyby, bakterie i owady. Emisja światła ma istotne znaczenie w życiu tych organizmów: służy do maskowania i ukrycia przed drapieżnikami, pomaga w lepszym komunikowaniu się, lepszym widzeniu w ciemności lub przyciąganiu zdobyczy.
W każdej żywej komórce oraz materiałach pochodzenia biologicznego obecny jest adenozynotrifosforan (ATP). Jedna komórka bakteryjna zawiera przeciętnie femtogram (10-15 g) ATP. Ilość adenozynotrifosforanu zależy od stanu fizjologicznego i rodzaju mikroorganizmu. Bakterie gramdodatnie zawierają około 10 razy więcej ATP niż bakterie gramujemne, natomiast spory bakteryjne nie zawierają go wcale. Komórki drożdżowe wykazują średnio około 100 razy więcej ATP niż komórki bakteryjne (tab.1).
Tabela 1. Zawartość ATP w komórkach różnych mikroorganizmów
|
Mikroorganizmy |
ATP [fg/komórkę] |
|
|
Bakterie |
Lactobacillus sp. |
2,0¸2,2 |
|
Pseudomonas fluorescens |
0,6 |
|
|
Escherichia coli |
1,0 |
|
|
Drożdże |
Kloeckera apiculata |
48,5 |
|
Pichia membranaefaciens |
90,7 |
|
|
Torulopsis sp. |
144,0 |
|
|
Saccharomyces cerevisiae |
155,0 |
|
Wielkość emisji światła jest wprost proporcjonalna do stężenia limitowanego reagenta. Np. w kompleksie ATP/lucyferyna-lucyferaza, gdy całkowita objętość mieszaniny reakcyjnej jest stała, a ATP jest reagentem limitowanym, emisja światła jest wprost proporcjonalna do stężenia ATP.
Reakcja bioluminescencji wymaga dla prawidłowego przebiegu odpowiednich parametrów fizycznych (pH, temperatura) oraz obecności jonów Mg+2 lub innych jonów metali na +2 stopniu utlenienia: Mn+2, Co+2, Fe+2, Ni+2 lub Zn+2. Luminescencja zachodzi w zakresie pH od 6,5 do 8,0, przy optimum wynoszącym 7,8-7,9. Wartość temperatury optymalnej związana jest z działaniem enzymu i wynosi ok. 25°C.
Wielkość emisji światła powstającego w reakcji luminescencji mierzona jest za pomocą luminometru w tzw. relatywnych jednostkach świetlnych (ang. relative light unit, RLU). Każdy luminometr zawiera komorę pomiarową, detektor, układ przetwarzający sygnał optyczny na elektryczny i podający wynik. Komora pomiarowa luminometru zawiera kuwetę, mikropłytkę lub inny typ naczynia reakcyjnego. Musi być chroniona przed światłem zewnętrznym, by zminimalizować możliwe zakłócenia pomiaru, oraz maksymalnie zbliżona do detektora w celu maksymalizacji efektu optycznego, pozwalającego na szybki i precyzyjny pomiar. Detektor luminometru stanowią fotodiody oraz przewody PMTs (ang. photomultipler tubes) umożliwiające amplifikację – kaskadę elektronów wzbudzoną przez foton emitowanego światła.
Zjawisko bioluminescencji odkryte w 1947 roku przez McElroy’a wzbudza coraz większe zainteresowanie naukowców. W latach 60-tych pomiar ATP metodą luminometrii został szerzej opisany przez naukowców NASA, którzy wykorzystali tę metodę do poszukiwania różnych form życia na innych planetach. Obecnie bioluminescencja stanowi podstawę działania różnorodnych czujników biologicznych. Czujniki bioluminescencyjne wykorzystano również jako wskaźniki stężenia azotanów, potencjalnie rakotwórczych związków N-nitrozowych, węglowodorów aromatycznych, metali ciężkich, utleniaczy i antyutleniaczy oraz innych toksycznych związków chemicznych. Wykorzystując bakterie bioluminescencyjne Vibrio fischeri opracowano bakteryjne testy toksyczności, mutagenności oraz rakotwórczości związków chemicznych. Obecnie najczęściej zjawisko bioluminescencji wykorzystuje się w badaniach mikrobiologicznego zanieczyszczenia wody, żywności i leków, do kontroli procesów opartych na hodowlach mikroorganizmów (oznaczanie biomasy, dynamiki wzrostu drobnoustrojów) oraz w diagnostyce klinicznej (oznaczanie wpływu antybiotyków na wzrost mikroorganizmów, ocena efektu działania leków i środków chemicznych na komórki zwierzęce).
Luminometria, w porównaniu do innych technik analitycznych, charakteryzuje się dużą czułością i dokładnością pomiarów, szerokim zakresem dynamicznym oraz stosunkowo niskim kosztem aparatury. Umożliwia dokładne pomiary biomasy i aktywności metabolicznej drobnoustrojów. Np. w porównaniu do innej metody oceny metabolizmu bakterii – pomiaru aktywności dehydrogenazy, luminometria jest ponad 3-krotnie czulsza i dostarcza wyników w czasie kilku minut od pobrania próbki, podczas gdy do pomiaru aktywności dehydrogenazy wymagana jest 6-cio godzinna inkubacja. Pomiar luminometryczny jest również odpowiednio 100 000 razy i 1000 czulszy niż spektroskopia absorpcyjna i fluorymetria. Dobry aparat luminometryczny może oznaczyć nawet 0,6 pg ATP.
Największe praktyczne zastosowanie metoda luminometrii znalazła w kontroli mikrobiologicznej produktów żywnościowych, kontroli stanu higienicznego powierzchni produkcyjnych, ocenie skuteczności procesów mycia i dezynfekcji oraz monitoringu w ramach systemu HACCP. Obecność ATP w próbkach pobranych do oceny stanu czystości w zakładzie wskazuje na istnienie różnych zanieczyszczeń organicznych (pozostałości roślinne, zwierzęce oraz mikroorganizmy). Metoda luminometryczna została wykorzystana do badania czystości samochodów transportujących żywność, np. cystern do przewożenia mleka, oraz do kontroli czystości opakowań szklanych i efektywności ich mycia. Technikę tę wykorzystano także do oceny mikrobiologicznego zanieczyszczenia plastikowych opakowań do żywności. Istniejące tradycyjne, znormalizowane metody wykrywania oraz ilościowego oznaczania drobnoustrojów są czasochłonne i nie dają możliwości natychmiastowej oceny aktualnego stanu higieny w zakładzie. Zależnie od stosowanej pożywki wyniki uzyskuje się co najmniej po 48 godzinnej inkubacji płytek/probówek, tj. w momencie gdy fragment instalacji lub urządzenie ze względów technologicznych jest już włączone do procesu technologicznego. Określenie obecności nie tylko żywych drobnoustrojów, ale także innych substancji organicznych, będących doskonałą pożywką dla mikroorganizmów, stanowi o wyższości metody luminometrycznej nad metodami hodowlanymi.
Metoda luminometrii może również znaleźć praktyczne zastosowanie w badaniu zdolności drobnoustrojów do adhezji na powierzchniach abiotycznych (rys. 2 i 3). Ma to istotne znaczenie zwłaszcza dla przemysłu spożywczego, gdyż mikroorganizmy o własnościach adhezyjnych wykazują zwykle większą oporność na środki dezynfekcyjne, a także pod wpływem działania środka dezynfekcyjnego przechodzą w stan tzw. niehodowalności (ang. viable but non-culturable, VBNC), tzn. nie są wykrywane klasycznymi metodami hodowlanymi.
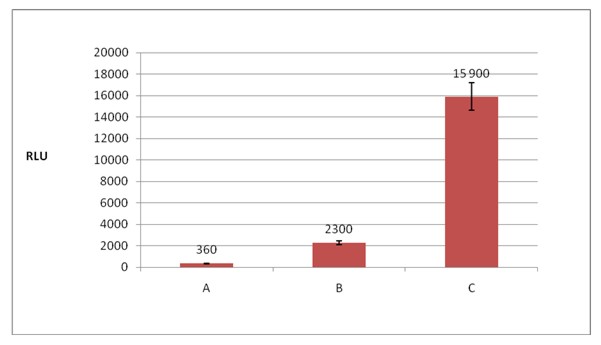
Rys. 2. Adhezja bakterii Aeromonas sp. do powierzchni abiotycznej – metoda luminometryczna: A – Próba kontrolna; B – Adhezja po 7 dniach; C – Adhezja po 3 tygodniach

Badania podatności materiałów na obrost biologiczny metodą luminometryczną prowadzone są w wielu ośrodkach naukowych.
Jako organizmy modelowe znajdują tu zastosowanie nie tylko bakterie, ale także grzyby lub komórki somatyczne. Biofilm tworzący się na powierzchniach gładkich (PCV, szkło, PET) pobiera się zwykle metodą wymazów, a następnie reakcje enzymatyczne prowadzi się z wykorzystaniem tzw. piór – gotowych zestawów odczynników do prowadzenia reakcji enzymatycznych. Biofilm tworzący się na powierzchniach chropowatych, szorstkich trzeba najpierw potraktować specjalnym odczynnikiem macerującym w celu pobrania ATP z wnętrza komórek, a następnie, wykorzystując gotowe pióra zanurzeniowe, prowadzić właściwe reakcje enzymatyczne.
Uzyskiwane wyniki badań uzyskiwane w pracowniach naukowych świadczą o tym, że pomiar luminometryczny może być z powodzeniem wykorzystywany nie tylko do oceny zdolności adhezyjnych drobnoustrojów do badanych powierzchni, ale także do oceny podatności materiałów na tworzenie biofilmów.
Literatura
- E.P. Ivanova, Y.V. Alexeeva, D.K. Pham, J.P. Wright, D.V. Nicolau: ATP level variations in heterotrophic bacteria during attachment on hydrophilic surfaces. International Microbiology 2006, Vol. 9, No 1, pp. 37-46.
- Kręgiel D. Bioluminescencja oraz jej praktyczne wykorzystanie. LAB, 2000, 2, 16-21.
- Kręgiel D. Problemy w mikrobiologicznej analizie wody – komórki żywe lecz nie dające się hodować. Przem. Spoż. 2005, 6, 32-41.
- Kręgiel D. Wykrywanie komórek bakterii VBNC w środowisku wodnym. – LAB 2005, 5, 6-45.
- Kręgiel D. Komórki VBNC-nowe wyzwanie dla współczesnej mikrobiologii. XIV Szkoła Fermentacji. 2009, Materiały, 202-212.
- Kręgiel D., Oberman H. Dwa spojrzenia na biofilmy w browarnictwie. XI Szkoła Technologii Fermentacji, Łódź 2006. Materiały,16-28.
- Kręgiel D., Rygała A. Występowanie heterotroficznych bakterii z rodzaju Aeromonas w wybranym systemie dystrybucji wody. Ochrona Środowiska 2010, 4, 47-50.
- D. Kręgiel, A. Rygała, W. Ambroziak, U. Mizerska, W. Fortuniak, J. Chojnowski: Investigation of the adhesion capabilities of Aeromonas hydrophila to different polysiloxane carriers. Biotechnology. Proceedings of the International Symposium on New Researches in Biotechnology Serie F. 2008, Special Volume, pp. 498-502.
- A.M. Olejnik, K. Czaczyk, R. Marecik, W. Grajek, T. Jankowski: Monitoring the progress of infection and recombinant protein production in insect cell cultures using intracellular ATP measurement. Appl. Microbiol. Biotechnol. 2004, Vol. 65, No 1, pp. 18-24
- M. Szczotko, B. Krogulska, A. Krogulski: Opracowanie metody oceny podatności materiałów kontaktujących się z wodą przeznaczoną do spożycia na powstawanie obrostów mikrobiologicznych. Roczniki PZH 2008, vol. 59, nr 1, ss. 103.
* Dorota Kręgiel, Instytut Technologii Fermentacji i Mikrobiologii, Politechnika Łódzka; dorota.kregiel@p.lodz.pl
