Wykrywanie komórek bakterii VBNC w środowisku wodnym
Obecnie szacuje się, że klasyczne metody płytkowe pozwalają na oznaczenie zaledwie 1-10% składu populacji stanowiącej określony ekosystem [1]. Rozbieżności między wynikami badań mikroskopowych a hodowlanych wynikają głównie z niemożności symulowania warunków środowiskowych zapewniających wzrost większości mikroorganizmów w warunkach laboratoryjnych. Znaczna część mikroorganizmów środowisk naturalnych, aktywna metabolicznie, jest niezdolna do wzrostu w postaci kolonii na dostępnych pożywkach agarowych [16]. Wprowadzenie pojęcia “żywe lecz nie dające się hodować” (VBNC – ang. viable but nonculturable) przez Byrda i Colwella w latach 80 ubiegłego stulecia dało początek niezwykle ważnym badaniom dotyczącym wykrywania tego rodzaju komórek w różnych środowiskach.
WYSTĘPOWANIE BAKTERII VBNC W WODZIE
Naturalne ekosystemy, np. woda, gleba, osady i muły stanowią środowisko bytowania dla zróżnicowanej populacji mikroorganizmów, w której występują komórki VBNC [1, 2]. Liczba rodzajów/gatunków bakterii tego stanu wykrywanych w środowisku wodnym stale wzrasta, szczególnie w ostatnim dwudziestoleciu. Większość badań dotyczących występowania stanu VBNC u mikroorganizmów dotyczy bakterii gramujemnych. Należą do nich populacje szczepów chorobotwórczych i oportunistycznych: Escherichia coli, Vibrio cholerae, Listeria monocytogenes, Legionella pneumophila, Salmonella enteritidis (serovar Typhimurium), Salmonella enterica, Citrobacter freundii, Campylobacter jejuni, Pseudomonas putida, Shigella dysenteriae (typ1), Enterobacter agglomerans. Jednak niezdolność wzrostu na pożywkach agarowych odnotowano także dla bakterii gramdodatnich: Micrococcus flavus, Enterococcus faecalis, Bacillus cereus, Listeria monocytogenes [4, 8].
Przejście komórek do fazy VBNC zachodzi głównie w warunkach stresogennych. Wiele czynników, m.in. temperatura, stężenie soli, tlen, dostępność składników pokarmowych, światło, wpływa na zdolność bakterii do podziału komórkowego.
W populacjach Salmonella Typhimurium wykazano heterogenność i sukcesję poszczególnych stanów fizjologicznych komórek wraz z podwyższeniem stopnia uszkodzeń komórkowych w tych populacjach [5]. Wyniki badań eksperymentalnych dowiodły, że możliwe jest indukowanie stanu VBNC w komórkach bakterii chorobotwórczych, należących do Salmonella sp., Campylobacter jejuni, Vibrio vulnificus, Vibrio parahaemolyticus, Yersinia enterocolitica oraz Escherichia coli [2].
Należy pamiętać, że komórki drobnoustrojów patogennych w stanie VBNC pozostają metabolicznie aktywne. Osiąganie przez szczepy patogenne lub oportunistyczne stanu VBNC stanowi poważny problem zdrowotny, zwłaszcza, że komórki takie charakteryzują się zwykle większą wirulencją niż komórki nie poddane warunkom stresogennym [4]. Przykład stanowić może Campylobacter jejuni, który występuje w dwóch różnych formach morfologicznych, typowej pałeczki i atypowej formie ziarniaka w stanie VBNC. Podobne zjawisko zmian morfologicznych i minituryzację komórek zaobserwowano u szczepów Escherichia coli i Helicobacter pylori w procesie osiagania stadium VBNC. Obydwie formy były zdolne do wywołania infekcji. Analizy chromatograficzne wykazały również modyfikacje w składzie chemicznym ściany komórkowej oraz wzrost właściwości autolitycznych komórek VBNC [14].
DETEKCJA KOMÓREK VBNC
Obecność w środowisku drobnoustrojów w stanie VBNC można wykazać wykorzystując metody oznaczania żywotności komórek, z wyłączeniem klasycznych metod hodowlanych. Do takich metod należy zaliczyć: pomiary potencjału membranowego, poziomu pH wewnątrz komórek, znakowanie komórek barwnikami fluorescencyjnymi, oznaczenia aktywności specyficznych enzymów, pomiar ATP oraz techniki DNA i RNA [2].
W celu rozróżniania żywych komórek i komórek VBNC w wodach naturalnych stosowana jest metoda bezpośrednia DVC (DVC- ang. direct-viable-count). Po kilkugodzinnej inkubacji w wodzie, bakterie są przenoszone do pożywki minimalnej zawierającej niewielkie ilości substancji odżywczych oraz inhibitor replikacji DNA: kwas nalidyksowy dla bakterii gramujemnych i enrofloksacynę lub ciprofloksacynę dla bakterii gramdodatnich. W tych warunkach metabolicznie aktywne komórki wykorzystują substancje pokarmowe i ulegają znacznemu wydłużeniu – elongacji [6] (fot. 1).
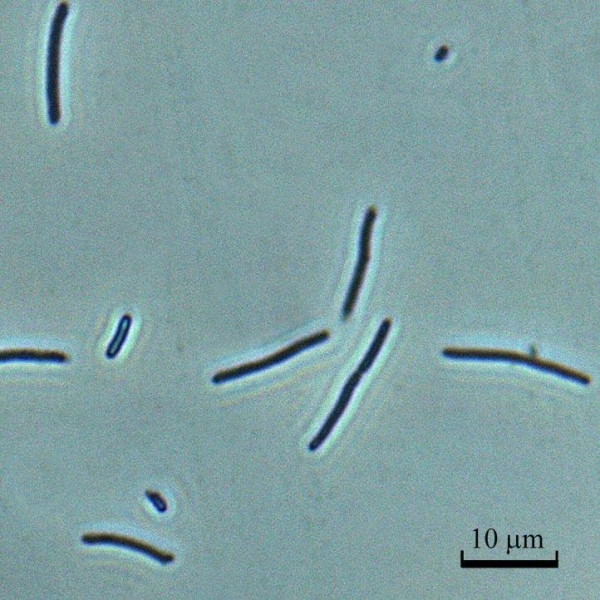
Fot. 1.
Obserwacje mikroskopowe komórek poddanych działaniu inhibitora replikacji DNA pozwalają na dokładne oszacowanie udziału w populacji komórek metabolicznie aktywnych (kilkakrotnie wydłużonych) i komórek niezdolnych do namnażania.
Szybkie oznaczenia żywotności i/lub aktywności metabolicznej komórek bakteryjnych wchodzących w skład zróżnicowanych populacji można osiągnąć stosując metody znakowania izotopowego, metody cytochemiczne, pomiar aktywności określonych dehydrogenaz lub metodę mikrokolonii.
W metodzie znakowania izotopami promieniotwórczymi komórki bakteryjne zawieszane są w medium zawierającym znakowany substrat zawierający 14C lub 3H. Metabolicznie aktywne komórki, zdolne do wykorzystania substratu, po włączeniu do przemian komórkowych 14C-znakowanej glukozy, wydzielają 14CO2 .
Do oznaczania komórek VBNC w populacjach bakteryjnych można zastosować również metodę barwienia z solami terazolowymi, np. INT [chlorek (2-(4-jodofenylo)-3-(4-nitrofenylo)-5-fenylo tetrazoliowy] lub CTC [chlorek 5-cyjano-2,3-ditolylo tetrazoliowy]. Związki tetrazolowe redukowane są przez dehydrogenazy do odpowiednich formazanów: niebieskiego INT-formazanu lub czerwonego CTC-formazanu o właściwościach fluorescencyjnych (rys. 1).
.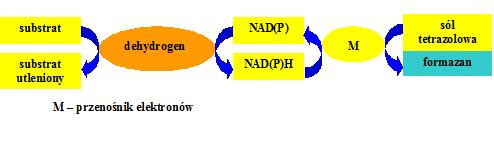
Rys. 1.
Dodatkowe barwienie komórek barwnikiem DAPI [4’,6-diamidino-2-fenyloindol], fluoryzującym na niebiesko, pozwala na lepszy kontrast i dokładniejsze liczenie żywych bakterii z zastosowaniem mikroskopii fluorescencyjnej [12, 13].
Aktywność dehydrogenaz związana jest z energetycznym metabolizmem komórek, stąd zdolność komórek do redukcji związków terazolowych może stanowić indykator żywotności komórek bakterii, w tym bakterii beztlenowych [3].
Wzajemne relacje między wynikami tradycyjnych metod płytkowych, bezpośrednich metod mikroskopowych z oranżem akrydyny oraz metod cytochemicznych z solami tetrazolowymi zostały opisane m.in. dla komórek Pseudomonas sp. Subpopulacja wykazująca aktywność oddechową w teście z INT była pod względem liczebności 10-krotnie większa niż inna subpopulacja komórek zdolnych do wzrostu w postaci kolonii [7].
Metoda mikrokolonii jest zbliżona do konwencjonalnych metod hodowlanych. Zdolność inkubowanych komórek do tworzenia mikrokolonii jest oceniana mikroskopowo. Jako niedoskonałość tej metody należy wymienić nie tylko krótki czas inkubacji ze względu na limitację tlenem i składnikami pokarmowymi, ale także akumulację szkodliwych metabolitów i tzw. „przerastanie” mikrokolonii. Metoda ta jest mało dokładna, gdyż pozwala na określenie żywotności populacji zawierającej co najmniej 106 komórek/ml. W ostatnich latach wprowadzono do omawianej metody szereg modyfikacji, np. mikrokolonie mogą być tworzone na filtrach membranowych umieszczonych na powierzchni stałych lub ciekłych pożywek, co pozwala na hodowle komórek bez limitacji tlenu i składników pokarmowych. Zwiększa to również szanse tworzenia mikrokolonii przez osłabione lub wolno rosnące komórki bakteryjne. Zastosowanie pożywek rozcieńczonych pozwala na uniknięcie przerastania mikrokolonii, a zastosowanie anaerostatów umożliwia wzrost beztlenowców. Wizualizacja formowanych mikrokolonii może być udoskonalona przy zastosowaniu mikroskopii flurescencyjnej i barwienia komórek, np. oranżem akrydyny. Opisane modyfikacje pozwalają na obniżenie poziomu detekcji do 104 komórek/ml. Obecnie coraz częściej łączy się technikę mikrokolonii z zastosowaniem fluorescencyjnie znakowanych przeciwciał, specyficznych dla szczepów z rodzajów Salmonella lub Pseudomonas [3].
W technikach genetycznych ekspresja genu z zastosowaniem indukcyjnych markerów genetycznych może służyć jako jedna z metod oznaczania żywotności komórek [4]. Zasada oznaczeń komórek VBNC oparta jest na ekstrakcji DNA/RNA oraz amplifikacji, klonowania i sekwencjonowania z wykorzystaniem łańcuchowej reakcji polimerazy (PCR), reakcji łańcuchowej polimerazy z odwrotną transkrypcją (RT-PCR, ang. reverse transcription polimerase chain reaction) i techniki NASBA (ang. nucleic acid sequence-based amplification) [9, 11, 14]. Porównanie wyników sekwencjonowania z bazą danych pozwala na identyfikację rodzajową lub nawet gatunkową badanych mikroorganizmów. Poprzez kombinację tych metod z techniką elektroforetycznego rozdzielania zamplifikowanych fragmentów DNA, możliwe jest nawet wyznaczenie profili zmian ilościowych w składzie danego ekosystemu [2].
Detekcję komórek VBNC w środowisku można prowadzić również metodą „gfp-tagging” poprzez wprowadzenie do materiału genetycznego bakterii genu gfp pobranego z bakterii E. coli [10]. Zielone białko florescencyjne GFP (ang. green fluorescent protein) kodowane przez gen gfp jest powszechnie stosowanym białkiem reporterowym, umożliwiającym monitorowanie ekspresji genu, a także lokalizację białka GFP w komórkach. Po ekspresji genu komórki transformowane produkują białko GFP, które można oznaczać ilościowo metodą fluorometryczną lub prowadzić obserwacje z zastosowaniem mikroskopu fluorescencyjnego.
Poznanie natury zjawiska VBNC oraz wykrycie i ilościowe oznaczenie szczepów w tym stanie fizjologicznym, stymuluje prace dotyczące doskonalenia procedur analitycznych z zastosowaniem szybkich metod detekcji i oceny żywotności poszczególnych komórek i całych populacji mikroorganizmów. Rozwój metod pozwalających precyzyjnie wykryć bakterie w stanie VBNC przyczyniłby się do znacznej poprawy kontroli bezpieczeństwa zdrowotnego wody w codziennej konsumpcji i użytkowaniu.
PIŚMIENNICTWO
1. Exner M., Vacata V., Gebel J. Public health aspects of the role of HPC – an introduction. In: Heterotrophic Plate Counts and Drinking Water. Ed. J. Bartram, J.Cotruvo, M.Exner, C. Fricker, A. Glasmacher. WHO, 2003, Publishing by IWA Publishing, London, UK.
2. Fleet G.H. Microorganisms in food ecosystems. Int. J. Food Microbiol., 1999, 50, 101-117
3. Nybroe O. Assessment of metabolic activity of single bacterial cells – new developments in microcolony and dehydrogenase assays. FEMS Microbiol. Ecol. 1995, 17, 77-84
4. Rowan N.J. Viable but non-culturable forms of food and waterborne bacteria: Quo vadis? Trends Food Sci. Technol. 2004, 15, 462-467.
5. Weichart D.H. Stability and survival of VBNC cells – conceptual and practical implications. Microbial Biosystems: New Frontiers. Proceedings of the 8th International Symposium on Microbial Ecology, Halifax, Canada, 1999.
6.Chae M.S., Schraft H. Cell viability of Listeria monocytogenes biofilms. Food Microbiol., 2001, 18, 103-112.
7.Leclerc H., Moreau A. Microbiological safety of natural mineral water. FEMS Microbiol. Rev. 2002, 26, 207-222.
8.Winfield M.D., Groisman E. A. Role of nonhost environments in the lifestyles of Salmonella and Escherichia coli. Appl. Environ. Microbiol. 2003, 69, 3687-3694.
9. Heim S., Del Mar Lleo M., Bonato B., Guzman. C.A., Canepari P. The viable but nonculturable state and starvation are different stress responses of Enterococcus faecalis, as determined by proteome analysis. J. Bacteriol. 2002, 184, 6739-6745.
10. Cho J-Ch., Kim S-J. Green fluorescent protein-based direct viable count to verify a viable but non-culturable state of Salmonella typhi in environmental samples. J. Microbiol. Methods. 1999, 36, 227-235.
11. Coleman S.S., Oliver J.D. Optimization of conditions for the polymerase chain reaction amplification of DNA from culturable and nonculturable cells of Vibrio vulnificus. FEMS Microbiol. Ecol. 1996, 19, 127-132.
12. Cappelier J.M., Lazaro B., Rossero A., Fernandez-Astorga A., Federighi M. Double staining (CTC-DAPI) for detection and enumeration of viable but non-culturable Campylobacter jejuni cells. Vet. Res. 1997, 28, 547-555.
13. Chaveerach P., ter Huurne A. A. H. M., Lipman L. J. A., van Knapen F. Survival and resuscitation of ten strains of Campylobacter jejuni and Campylobacter coli under acid conditions. Appl. Environ. Microbiol. 2003, 69, 711-714.
14. Dahm H., Strzelczyk E. Żywe lecz nie dające się hodować bakterie. Post. Mikrobiol. 2004, 43, 251-265.
15. Ishiyama M. Why is the water-soluble formazan necessary? Dojindo Newsletter, 2 (http://www.dojindo.com/newsletter.html)
16. Kozdrój J. Różnorodność mikroorganizmów glebowych w świetle badań molekularnych. Post. Mikrobiol. 2004, 43, 375-398.
